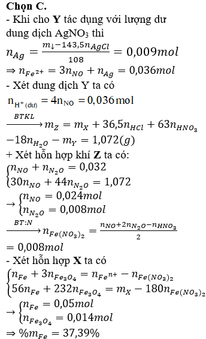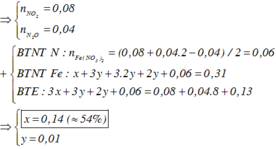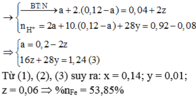Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
- Thêm AgNO3 vào Y thấy tạo thêm NO chứng tỏ Y chứa Fe2+, H+ dư và không còn NO3-
=> Y + AgNO3 có phản ứng:
Ag+ + Cl- → AgCl
Ag+ + Fe2+ → Ag + Fe3+
Bảo toàn nguyên tố Cl: nAgCl = nCl = 0,3 mol
Có: mtủa = mAg + mAgCl => mAg = 44,022 – 143,5.0,3 = 0,972 g
=> nAg = 0,009 mol
Bảo toàn electron: nFe2+ = 3nNO + nAg = 3.0,009 + 0,009 = 0,036 mol
nH+ dư = 4nNO = 0,036 mol
Vậy dung dịch Y chứa Fe2+(0,036 mol) ; H+ (0,036 mol) ; Cl- (0,3 mol) và Fe3+
Bảo toàn điện tích: 2nFe2+ + 3nFe3+ + nH+ = nCl- => nFe3+ = 0,064 mol
Đặt số mol Fe, Fe3O4, Fe(NO3)2 lần lượt là a, b, c.
Có: mX = 56a + 232b + 180c = 7,488 (1)
Bảo toàn Fe: nFe = a + 3b + c = nFe2+ + nFe3+ = 0,1 mol(2)
nH+ pứ = nHCl bđ + nHNO3 – nH+(Y) = 0,3 + 0,024 – 0,036 = 0,288 mol
Bảo toàn H: nH2O = ½ nH+ pứ = 0,144 mol
Bảo toàn O: 4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nH2O + nNO + nN2O
=> 4b + 6c = 0,104 mol(3)
Từ (1,2,3) => a = 0,05 ; b = 0,014 ; c = 0,008
=> %mFe = 56.0,05/7,488 = 37,4% (Gần nhất với giá trị 37,8%)

Đáp án : A
Dd Y + dd AgNO3:
3Fe2+ + 4H+ + NO3 – → 3 Fe3+ + NO + 2H2O
0,06← 0,08← 0,02 ← 0,02
Kết tủa gồm AgCl và Ag. Trong đó: n AgCl = n HCl = 0,88 mol
=> m Ag = 133,84 – 0,88. 143,5 = 7,56 gam
=> n Ag = 0,07 mol
Fe2+ + Ag+ → Fe3+ + Ag
0,07← 0,07 0,07 0,07
=> ∑ n Fe2+ (ddY) = 0,06 + 0,07 = 0,13 mol
n H+ dư (ddY) = 0,08 mol
=> dd Y gồm Fe+ ; Fe3+; H+ và Cl –
Bảo toàn điện tích trong dd có: 2 n Fe2+ + 3n Fe3+ + n H+ = n Cl –
<=> 3 n Fe3+ = 0,88 – 2. 0,13 – 0,08 = 0,54 mol
<=> n Fe3+ = 0,18 mol
Mặt khác, có ∑ n H+ bđ = 0,88 + 0,04 = 0,92 mol
=> n H+ p.ư = 2. n H2O = 0,84 mol
=> n H2O = 0,42 mol
X + HCl + HNO3 → Muối + axit dư + khí + H2O
(0,88 mol) (0,04 mol)
BTKL => m khí = 27,04 + 0,88. 36,5 + 0,04. 63 – 0,42. 18 – 0,31. 56 – 0,08 – 0,88. 35,5 = 5,44 gam
Gọi n N2O = x mol; n NO = y mol
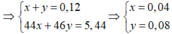
BT nguyên tố N: có n N [Fe(NO3)2] + n N(HNO3) = n N(sp khử)
=> 2. n Fe(NO3)2 + 0,04 = 0,04. 2 + 0,08 = 0,16
=> n Fe(NO3)2 = 0,06 mol
=> m Fe + m FeO + m Fe2O3 + m Fe3O4 (hhX) = 27,04 – 0,06. 180 = 16,24 gam (I)
Mặt khác, n FeO : Fe3O4 : n Fe2O3 = 3: 2: 1
=> Đặt n Fe2O3 = a => n Fe3O4 = 2a và n FeO = 3a
Đặt n Fe = b
Theo (I) => 56b + 840 a = 16,24 (1)
∑ n Fe(I) = 0,31 – 0,06 = 0,25 <=> b + 11a = 0,25 (2)
Từ (1) và (2) => a = 0,01 và b = 0,14 mol
=> % m Fe = (0,14. 56) : 27,04 = 28,99%

Đáp án C
+ T r o n g X : n F e = x ; n F e O = 3 y ; n F e 3 O 4 = 2 y ; n F e 2 O 3 = y ; n F e ( N O 3 ) 2 = z + P Ư 1 : X d d Y + . . . P Ư 2 : Y N O + . . . ⇒ Y c h ứ a C l - : 0 , 88 m o l H + , F e 2 + , F e 3 + + n H + t r o n g Y = 4 n N O = 0 , 08 n F e 2 + t r o n g Y = 3 n N O + n A g ⇒ n H 2 O t ạ o r a ở P Ư 1 = 0 , 88 + 0 , 04 - 0 , 08 2 = 0 , 42 n F e 2 + t r o n g Y = 3 . 0 , 02 + ( 133 , 84 - 0 , 88 . 143 , 5 ) 108 = 0 , 13 + B T ~ N T c h o Y ⇒ n F e 3 + = 0 , 18 ⇒ m c á c c h ấ t tan t r o n g Y = 48 , 68 + n N O 2 + n N 2 O = 0 , 12 46 n N O 2 + 44 n N 2 O = m X + m a x i t - m c h ấ t tan t r o n g Y - m H 2 O = 5 , 44 ⇒ n N O 2 = 0 , 08 n N 2 O = 0 , 04 + B T N T N : n F e ( N O 3 ) 2 = ( 0 , 08 + 0 , 04 . 2 - 0 , 04 ) / 2 = 0 , 06 B T N T F e : x + 3 y + 3 . 2 y + 2 y + 0 , 06 = 0 , 31 B T E : 3 x + 3 y + 2 y + 0 , 06 = 0 , 08 + 0 , 04 . 8 + 0 , 13 ⇒ x = 0 , 14 ( ≈ 54 % ) y = 0 , 01