Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Dấu hiệu : Viên kẽm tan dần và sủi bọt
b) \(Zn+2HCl\rightarrow H_2+ZnCl_2\)
a/ Dấu hiệu cho thấy có phản ứng xảy ra là viên kẽm đã tan dần, đồng thời có sủi bọt khí => Có biến đổi tính chất hóa học
b/PTHH: Zn +2HCl ===> ZnCl2 + H2

`Zn + 2HCl -> ZnCl_2 + H_2`
`0,1` `0,2` `0,1` `(mol)`
`n_[Zn]=[6,5]/65=0,1(mol)`
`a)V_[H_2]=0,1.22,4=2,24(l)`
`b)C%_[HCl]=[0,2.36,5]/200 . 100 =3,65%`
`Zn + HCl -> ZnCl_2 + H_2` `\uparrow`
`n_(Zn) = (6,5)/65 = 0,1 mol`.
`n_(H_2) = 0,1 mol`.
`V(H_2) = 0,1 xx 22,4 = 2,24l`.
`C%(HCl) = (0,2.36,5)/200 xx 100 = 36,5%`.

Nzn=0,1mol
a) có pt : Zn + 2Hcl -> ZnCl2 + H2
1 -> 2 -> 1 -> 1 mol
0,1-> 0,2 -> 0,1 -> o,1 mol
b) số Hcl đã dùng khi pứ là :
0,2 . 36,5= 7,3
-> số gam hcl dư là 10,95- 7,3=3,65(g)
c)mZnCl2=0,1 . 136=13,6g

Chất tan là viên kẽm
Dung môi là axit clohidric
Dung dịch là hỗn hợn sau khi hòa tan
Câu này có xảy ra PTHH , tạo ra ZnCl2 nên chất tan là ZnCl2 luôn ( muối khan sau khi tách nước ) còn dung môi là nước dư ở trong dd HCl . Dung dịch là dung dịch ZnCl2

a) Lập công thức hóa học của muối kẽm clorua: Z n C l 2
b) Khối lượng muối Z n C l 2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)

a, b, Chung hiện tượng nhé:
Zn, Al tan trong dd HCl sủi bọt khí ko màu, ko mùi, ko vị, đó là H2
PTHH:
Zn + 2HCl -> ZnCl2 + H2
2Al + 6HCl -> 2AlCl3 + 3H2
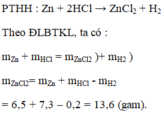
câu hỏi là gì hả cậu