Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(4Al+3O_2-^{t^o}>2Al_2O_3\) Phản ứng hóa hợp
\(2KMnO_4-^{t^o}>K_2MnO_4+MnO_2+O_2\) phản ứng phân hủy
\(2Al+6HCl->2AlCl_3+3H_2\) phản ứng thế
\(Fe_2O_3+3H_2-^{t^o}>2Fe+3H_2O\) phản ứng thế
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\left(P.Ứ.hoá.hợp\right)\\ 2KMnO_4\rightarrow\left(t^o,xt\right)K_2MnO_4+MnO_2+O_2\left(P.Ứ.phân.huỷ\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\left(P.Ứ.thế\right)\\ Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\left(P.Ứ.thế\right)\)

\(1,2KClO_3\xrightarrow[xtMnO_2]{t^o}2KCl+3O_2\\
O_2+S\underrightarrow{t^o}SO_2\\
2SO_2+O_2\xrightarrow[xtV_2O_5]{t^o}2SO_3\\
SO_3+H_2O\rightarrow H_2SO_4\\
Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(2,2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\\
2H_2+O_2\underrightarrow{t^o}2H_2O\\
H_2O+SO_3\rightarrow H_2SO_4\\
Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(3,2H_2O\underrightarrow{\text{đ}p}2H_2+O_2\\
4Na+O_2\underrightarrow{t^o}2Na_2O\\
Na_2O+H_2O\rightarrow2NaOH\)
\(4,2KClO_3\xrightarrow[xtMnO_2]{t^o}2KCl+3O_2\\
2H_2+O_2\underrightarrow{t^o}2H_2O\\
2H_2O\underrightarrow{\text{đ}p}2H_2+O_2\\
H_2+CuO\underrightarrow{t^o}Cu+H_2O\\
2Cu+O_2\underrightarrow{t^o}2CuO\)

Lập phương trình hóa học của các phản ứng sau và cho biết chúng thuộc loại phản ứng hóa học nào .
a, 2KNO3 -to--> 2KNO2 + O2 ( Phản ứng phân hủy )
b, 2Al + 3Cl2 ---> 2AlCl3 ( Phản ứng hóa hợp )
c, Zn + 2HCl ---> ZnCl2 + H2 ( Phản ứng thế )
d, 2KClO3 -to--> 2KCl + 3O2 ( Phản ứng phân hủy )
e, 2Fe + 3Cl2 ---> 2FeCl3 ( Phản ứng hóa hợp )
f, 2Fe(OH)3 --to-> Fe2O3 + 3H2O ( Phản ứng phân hủy )
g, C + 2MgO ---> 2Mg + CO2 ( Phản ứng thế )

\(a,S+O_2\underrightarrow{t^o}SO_2\) ( hóa hợp )
\(b,2Al+3O_2\underrightarrow{t^o}2Al_2O_3\) ( hóa hợp )
\(c,2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\) ( phân hủy )
\(d,2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\) ( phân hủy )
a) \(S+O_2\xrightarrow[]{t^0}SO_2\left(phản.ứng.hoá.hợp\right)\)
b)\(4Al+3O_2\xrightarrow[t^0]{}2Al_2O_3\left(phản.ứng.hoá.hợp\right)\)
c) \(2KMnO_4\xrightarrow[t^0]{}K_2MnO_4+MnO_2+O_2\left(phản.ứng.phân.huỷ\right)\)
d)\(2KClO_3\xrightarrow[t^0]{}2KCl+3O_2\left(phản.ứng.phân.huỷ\right)\)

\(Mg+H_2SO_4->MgSO_4+H_2\\ 2KClO_3-^{t^o}>2KCl+3O_2\\ 3H_2+Fe_2O_3->2Fe+3H_2O\\ 4Al+3O_2-^{t^o}>2Al_2O_3\\ CH_4+2O_2-^{t^o}>CO_2+2H_2O\\ O_2+S-^{t^o}>SO_2\\ H_2+CuO-^{t^o}>Cu+H_2O\\ 2KMnO_4-^{t^o}>K_2MnO_4+MnO_2+O_2\\ Zn+2HCl->ZnCl_2+H_2\\ 4P+5O_2-^{t^o}>2P_2O_5\)
Đốt cháy hoàn toàn 5,4 g kim loại nhôm Al trong khí oxi. a. Tính thể tích khí oxi (đktc) cần dùng cho phản ứng. b. Tính khối lượng KClO3 cần dùng để điều chế lượng oxi trên.

\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\) - phản ứng hóa hợp
\(2Mg+O_2\rightarrow\left(t^o\right)2MgO\) - phản ứng hóa hợp
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\) - phản ứng hóa hợp
\(4Na+O_2\rightarrow\left(t^o\right)2Na_2O\) - phản ứng hóa hợp
\(H_2+CuO\rightarrow\left(t^o\right)Cu+H_2O\) - phản ứng oxi hóa- khử, phản ứng thế
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\) - phản ứng phân hủy
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\) - phản ứng hóa hợp
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\) - phản ứng hóa hợp
\(Zn+2HCl\rightarrow ZnCl_2+H_2\) - phản ứng thế
\(2O_2+CH_4\rightarrow\left(t^o\right)CO_2+2H_2O\) - phản ứng oxi hóa, khử
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\) - phản ứng hóa hợp
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\) - phản ứng phân hủy
a. 4P + 5O2 -> 2P2O5 ( Phản ứng hóa hợp )
b. 2Mg + O2 -> 2MgO ( Phản ứng hóa hợp )
c. 4Al + 3O2 -> 2Al2O3 ( Phản ứng hóa hợp )
d. 4Na + O2 -> 2Na2O ( Phản ứng hóa hợp )
e. H2 + CuO -> Cu + H2O ( Phản ứng thế )
. 2KMnO4 -> K2MnO4 + MnO2 + O2 ( Phản ứng phân hủy )
f. 4Fe + 3O2 -> 2Fe2O3 ( Phản ứng hóa hợp )
g. 2H2 + O2 -> 2H2O ( Phản ứng hóa hợp )
h Zn + 2HCl -> ZnCl2 + H2 ( Phản ứng thế )
i. 2O2 + CH4 -> CO2 + 2H2O ( Phản ứng thế )
j. Nãy làm rồi
k. 2KClO3 -> 2KCl + 3O2 ( Phản ứng phân hủy )

\(1,Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\)
Phản ứng thế
\(2,P_2O_5+3H_2O\rightarrow2H_3PO_4\)
Phản ứng hoá hợp
\(3,Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
Phản ứng thế
\(4,4P+5O_2\xrightarrow[]{t^o}2P_2O_5\)
Phản ứng hoá hợp
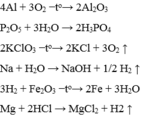
4Al + 3O2 -> (t°) 2Al2O3 (phản ứng hóa hợp)
2KMnO4 -> (t°) K2MnO4 + MnO2 + O2 (phản ứng phân hủy)
S + O2 -> (t°) SO2 (phản ứng hóa hợp)
2H2 + O2 -> (t°) 2H2O (phản ứng hóa hợp)
Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O (phản ứng oxi hóa khử)
Mg + 2HCl -> MgCl2 + H2 (phản ứng thế)