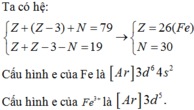Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 2:
\(m_{HF}=\dfrac{2,5.40\%}{100\%}=1(kg)\\ \Rightarrow n_{HF}=\dfrac{1}{20}=0,05(kmol)\\ PTHH:CaF+H_2SO_4\to CaSO_4+2HF\\ \Rightarrow n_{CaF}=0,025(kmol)\\ \Rightarrow m_{CaF}=0,025.78=1,95(kg)\)
Bài 3:
\(a,\) Đặt \(\begin{cases} n_{Fe}=x(mol)\\ n_{Al}=y(mol) \end{cases} \)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow \begin{cases} 56x+27y=11\\ x+1,5y=0,4 \end{cases} \Rightarrow \begin{cases} x=0,1(mol)\\ y=0,2(mol) \end{cases}\\ \Rightarrow \begin{cases} \%_{Fe}=\dfrac{0,1.56}{11}.100\%=50,91\%\\ \%_{Al}=100\%-50,91\%=49,09\% \end{cases} \)
\(b,\Sigma n_{HCl}=3n_{Al}+2n_{Fe}=0,2+0,6=0,7(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,7}{2}=0,35(l)\)

a) \(Fe_2\left(SO_4\right)_3+6KOH->2Fe\left(OH\right)_3\downarrow+3K_2SO_4\)
\(Fe^{3+}+3OH^-->Fe\left(OH\right)_3\)
b) \(Pb\left(NO_3\right)_2+H_2S->PbS\downarrow+2HNO_3\)
\(Pb^{2+}+S^{2-}->PbS\)
c) \(Fe+6HNO_3-->Fe\left(NO_3\right)_3+3NO_2+3H_2O\)
\(Fe+6H^++3NO_3^-->Fe^{3+}+3NO_2+3H_2O\)

Chọn đáp án B.
Dễ dàng nhìn thấy L- , E2- , T, M+ đều có cùng cấu hình electron của khí hiếm Ar.

Chọn đáp án D.
Ta thấy Cl- (18e), Mg2+ (10e), S2- (18e) đều đạt cấu hình của khí hiếm Ar và Ne → Chỉ có Fe3+ (23e) không đạt cấu hình của khí hiếm

Chọn đáp án C.
Dựa vào cấu hình electron của X và Y ta suy ra X là K (Z = 19) và Y là F (Z = 9) → Liên kết giữa Kali và Flo là liên kết giữa kim loại điển hình và phi kim điển hình → Liên kết ion.

Cấu hình electron của cation X 2 + là 1 s 2 2 s 2 2 p 6 có 10 electron → X có 12e (Vì X đã nhường đi 2e tạo thành cation X 2 + ) → X là Mg ( Z = 12).
Chọn đáp án B.

Ở trạng thái cơ bản, cả cacbon và oxi đều có 2 e độc thân ở phân lớp 2p. Do đó chúng có thể tạo thành 2 liên kết cộng hóa trị. Do oxi còn 1 cặp e chưa tham gia liên kết, cacbon còn orbital trống nên giữa chúng hình thành liên kết cho nhận
Vì cặp e từ oxi nên mũi tên của liên kết cho nhận có chiều từ oxi sang cacbon
Đáp án D