Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CuO + H2 \(-^{t^o}\rightarrow\) Cu + H2O (1)
3Cu + 8HNO3 \(\rightarrow\) 3Cu(NO3)2 + 2NO + 4H2O (2)
CuO + 2HNO3 \(\rightarrow\) Cu(NO3)2 + 2NO + 4H2O (3)
Ta có : nNO = 0,2 mol.
Theo (2) :\( n_{Cu}=\frac{3}{2}n_{NO}=0,3\) mol ; \(n_{HNO_{3}}=\frac{8}{3}n_{NO}=0,8 (mol).\)
Theo (3) : \(n_{CuO}=\frac{1}{2}n_{HNO_{3}}=\frac{1}{2}(1-0,8)=0,1(mol).\)
=> nCuO ban đầu = 0,1 + 0,3 = 0,4 (mol)
Hiệu suất của quá trình khử CuO là :\( H = \frac{0,3}{0,4}.100=75%.\)
=> Chọn B.

Đáp án B
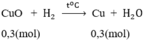
Số mol HNO3: nHNO3 = 1. 1 = 1(mol)
Số mol NO: 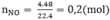
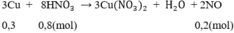
Theo pt: nHNO3 = 4. nNO = 4. 0,2 = 0,8 mol
nHNO3 còn lại = 1 – 0,8 = 0,2 (mol)
⇒ CuO dư phản ứng với HNO3
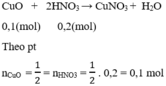
⇒ Tổng nCuO = 0,1 + 0,3 = 0,4 mol
Ban đầu 0,4 mol CuO, phản ứng 0,3 mol CuO
Hiệu suất 

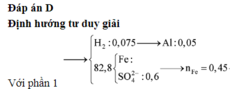
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D

Giải thích:
Phần 1:
nH2 = 0,075 => nAldư = 0,05
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
8x→ 3x →4x → 9x
Chất rắn không tan trong NaOH là Fe (9x mol). Với H2SO4 đặc nóng
=> Fe3+ (u) và Fe2+ (v)
Bảo toàn electron: 3u + 2v = 0,6 . 2
m muối = 400a/2 + 152b = 82,8
=> u = 0,3 và v = 0,15
=> 9x = u + v => x = 0,05
Vậy phần 1 chứa Al (0,05), Al2O3 (0,2) và Fe (0,45)
=> mPhần 1 = 46,95
=> mPhần 2 = mX - mPhần 1 = 187,8
=> mPhần 2 = 4mPhần 1
Vậy phần 2 chứa các chất có số mol gấp 4 phần 1.
Phần 2 chứa Al (0,2), Al2O3 (0,8) và Fe (1,8)
=> nO = 0,8 . 3 = 2,4
nH+ = 12,97 = 4nNO + 2nNO2 + 2nO + 10nNH4+
=> nNH4+ = 0,015
Dung dịch A chứa Fe3+ (a mol), Fe2+ (y mol) và các ion khác.
Bảo toàn Fe => a + b = 1,8
Bảo toàn electron => 3a + 2b + 0,2 . 3 = 1,25 . 3 + 1,51 + 0,015 . 8
=> a = 1,18 và b = 0,62
Đáp án D

Chọn đáp án C
Áp dụng định luật bảo toàn electron có: n A g = 3 n N O = 3. 4 , 48 22 , 4 = 0 , 6 m o l
⇒ n H C H O = 1 4 n A g = 0 , 6 4 = 0 , 15 m o l ⇒ m C H 3 O H = 14 , 1 − 30.0 , 15 = 9 , 6 g ⇒ n C H 3 O H = 0 , 3 m o l m C H 3 C O O C H 3 = 74.0 , 3 = 22 , 2 g
⇒ Hiệu suất este hóa: H % = 16 , 65 22 , 2 .100 % = 75 %
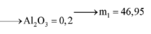
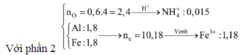
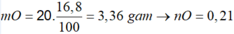
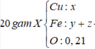
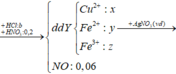
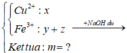
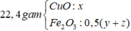
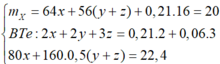
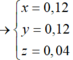
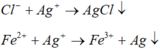
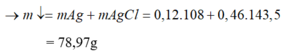

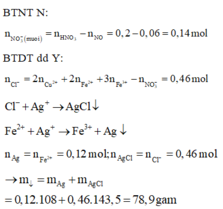
1.
Quy đổi bài toán thành:
{CH3-CH(NH2)-COOH (x mol); HCl (0,35 mol)} + KOH: 1,2 mol → Sản phẩm
Như vậy: nKOH = n Ala + nHCl
\(\text{→ nAla = nKOH - nHCl = 1,2 - 0,35 = 0,85 mol}\)
\(\text{→ m = 0,85.89 = 75,65 gam}\)
2.
n axit = 0,1 mol, n ancol = \(\frac{3}{23}\) mol
CH3COOH + C2H5OH \(\rightarrow\) CH3COOC2H5 + H2O
\(\frac{naxit}{1}\) < n \(\frac{ancol}{1}\)
\(\rightarrow\) Hiệu suất tính theo CH3COOH
\(\text{n este = 0,5.n axit = 0,5.0,1 = 0,05 mol}\)
\(\rightarrow\) m este = 0,05.88 = 4,4g
3.