Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
a, Ta có :
\(m_{Ct_{HCl}}=\frac{20}{100}.91,25=18,25\left(g\right)\)
\(\rightarrow n_{HCl}=\frac{18,25}{36,5}=0,5\left(mol\right)\)
Gọi số mol của Fe là x , số mol của Fe2O3 là y
Theo đề bài :
\(56x+160y=13,6\) (1)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
x_____2x_______________x
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
y_______6y__________________
\(\rightarrow2x+6y=0,5\) (2)
Giải hệ phương trình (1) và (2) ta có :
\(\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\rightarrow\%_{Fe}=\frac{0,1.56}{13,6}.100\%=41,18\%\)
\(\%_{Fe2O3}=100\%-41,18\%=58,82\%\)
b, \(m_{dd_{spu}}=13,6+91,25-0,1.2=104,65\left(g\right)\)
Mà \(n_{H2}=n_{Fe}=0,1\left(mol\right)\)
Theo phương trình : \(nFeCl_2=n_{Fe}=0,1\left(mol\right)\)
\(\rightarrow\%_{FeCl2}=\frac{0,1.127}{104,65}.100\%=12,14\%\)
Theo phương trình : \(n_{FeCl3}=2n_{Fe2O3}=0,05.2=0,2\left(mol\right)\)
\(\rightarrow\%_{FeCl3}=\frac{0,1.162,5}{104,65}.100\%=15,53\%\)
Bài 2:
\(KCl+AgNO_3\rightarrow AgCl+KNO_3\)
x ________________x__________
\(NaCl+AgNO_3\rightarrow AgCl+NaNO_3\)
y _______________ y_____________
Giải hệ phương trình :
\(\left\{{}\begin{matrix}74,5x+58,5y=26,5\\143,5x+143,5y=57,4\end{matrix}\right.\rightarrow x=y=0,2\left(mol\right)\)
\(C\%_{KCl}=\frac{0,2.74,5}{500}.100\%=2,98\%\)
\(C\%_{NaCl}=\frac{0,2.58,5}{500}.100\%=2,34\%\)
Bài 3:
\(m_{dd_{HCl}}=1,19.100,8=119,952\)
\(m_{HCl}=119,952.36,5\%=43,78248\)
\(n_{HCl}=1,19976\)
\(\rightarrow n_{H2}=0,4\left(mol\right)\)
\(PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
_______0,4____0,8______________0,4_(mol)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
0,19976____0,19952__________________
\(\rightarrow m_A=0,4.65+0,19976.\left(65+16\right)\)
\(=42,18\)

Câu 1:
Gọi số mol NaCl, KCl là a, b (mol)
=> 58,5a + 74,5b = 6,81 (1)
\(n_{AgCl}=\dfrac{14,35}{143,5}=0,1\left(mol\right)\)
Bảo toàn Cl: a + b = 0,1 (2)
(1)(2) => a = 0,04 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}m_{NaCl}=0,04.58,5=2,34\left(g\right)\\m_{KCl}=0,06.74,5=4,47\left(g\right)\end{matrix}\right.\)
Câu 2:
Gọi số mol MgCl2, KCl là a, b (mol)
=> 95a + 74,5b = 3,93 (1)
25ml dd A chứa \(\left\{{}\begin{matrix}MgCl_2:0,05a\left(mol\right)\\KCl:0,05b\left(mol\right)\end{matrix}\right.\)
nAgNO3 = 0,05.0,06 = 0,003 (mol)
=> nAgCl = 0,003 (mol)
Bảo toàn Cl: 0,1a + 0,05b = 0,003 (2)
(1)(2) => a = 0,01 (mol); b = 0,04 (mol)
\(\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,01.95}{3,93}.100\%=24,173\%\\\%m_{KCl}=\dfrac{0,04.74,5}{3,93}.100\%=75,827\%\end{matrix}\right.\)

Chúc bạn học tốt !!!
\(m_{hh}=74.5a+58.5b=26.6\left(g\right)\left(1\right)\)
\(n_{AgCl}=\dfrac{57.4}{143.5}=0.4\left(mol\right)\)
\(KCl+AgNO_3\rightarrow KNO_3+AgCl\)
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\)
\(n_{AgCl}=a+b=0.4\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=b=0.2\)
\(m_{dd\left(saupư\right)}=26.6+500-57.4=469.2\left(g\right)\)
\(C\%_{KNO_3}=\dfrac{0.2\cdot101}{469.2}\cdot100\%=4.31\%\)
\(C\%_{NaNO_3}=\dfrac{0.2\cdot85}{469.2}\cdot100\%=3.62\%\)



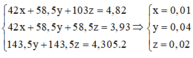
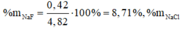
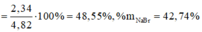
11) Theo đề, ta có: \(n_{MnO_2}=\dfrac{78,3}{87}=0,9\left(mol\right)\)
PTHH: \(MnO_2+4HCl\rightarrow MnCl_2+2H_2O+Cl_2\left(1\right)\)
Số mol: 0,9 mol 3,6 mol 0,9 mol 1,8 mol 0,9 mol
a, Theo phương trình, ta có: \(n_{HCl}=4n_{MnO_2}=4.0,9=3,6\left(mol\right);n_{Cl_2}=n_{MnO_2}=0,9\left(mol\right)\)
\(\Rightarrow m_{HCl}=3,6.36,5=131,4\left(g\right)\)
Mặt khác, C% dung dịch HCl = \(\dfrac{m_{HCl}}{m_{ddHCl}}.100\%\) \(\Leftrightarrow20\%=\dfrac{131,4}{m_{ddHCl}}.100\%\Leftrightarrow m_{ddHCl}=\dfrac{131,4.100}{20}=657\left(g\right)\)(\(m_{ddHCl}\) là khối lượng dung dịch HCl).
\(V_{Cl_2}=0,9.22,4=20,16\left(l\right)\)
b, Theo phương trình, \(n_{MnCl_2}=n_{MnO_2}=0,9\left(mol\right)\)
\(\Rightarrow m_{MnCl_2}=0,9.126=113,4\left(g\right)\)
Mặt khác,
mdung dịch sau phản ứng = \(m_{MnCl_2}+\) mdung dịch HCl - \(m_{Cl_2}\)
= \(78,3+657-\left(0,9.35,5.2\right)\)
= 671,4 (g)
\(\Rightarrow C\%\)dung dịch \(MnCl_2\) = \(\dfrac{113,4}{671,4}.100\%=16,89\%\)
c, Theo (1), \(n_{Cl_2}=n_{MnCl_2}=0,9\left(mol\right)\)
PTHH: \(Fe+\dfrac{3}{2}Cl_2\rightarrow FeCl_3\left(2\right)\)
Số mol: 0,6 \(\rightarrow\) 0,9 \(\rightarrow\) 0,6
Theo (2) \(\Rightarrow n_{FeCl_3}=n_{Fe}=0,6\left(mol\right)\)
\(\Rightarrow m_{FeCl_3}=0.6.162,5=97,5\left(g\right)\)
\(\Rightarrow m\) dung dịch muối thu được = 97,5 + 52,5 =150 (g).
\(\Rightarrow C\%\)dung dịch \(FeCl_3\)= \(\dfrac{97,5}{150}.100\%=65\%\)