Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Các phương trình phản ứng :
M tác dụng với O2: 4 M + 2 n O 2 → t 0 2 M n O n
Chất rắn sau phản ứng tác dụng với dung dịch HCl thu được khí H2, chứng tỏ chất rắn sau có M dư nên O2 hết - chất rắn sau gồm M dư và M2On :
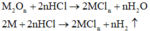
Tính toán:
Số mol H2 thu được là: n H 2 = 13 , 44 22 , 4 = 0 , 6 m o l
Sơ đồ phản ứng:
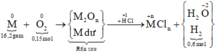
Các quá trình nhường, nhận electron cho cả quá trình:
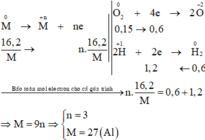

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.

Gọi n là hóa trị cao nhất của L, m là hóa trị thấp nhất, x là số mol pứ
n có thể = m hoặc n>m
\(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Cho L tác dụng với Cl2:
\(L+\dfrac{n}{2}Cl_2\underrightarrow{t^o}LCl_n\)
x x
Vì \(LCl_n\) không tác dụng với HCl nên chất rắn X gồm L dư và \(LCl_n\)
\(2L+2mHCl\rightarrow2LCl_m+mH_2\)
\(\dfrac{0,12}{m}\) 0,06
Ta có:
\(n_{L.pứ}=x=0,0775-\dfrac{0,12}{m}=nLCl_n\)
=> \(L.\dfrac{0,12}{m}+\left(0,0775-\dfrac{0,12}{m}\right).\left(L+35,5n\right)=3,0125\)
Với n = m = 2
=> L = 24
Vậy kim loại L là Mg.
☕T.Lam✿

Đáp án D.
Chất rắn không tan là Cu.
![]()
Zn + 2HCl → ZnCl2 + H2
0,2 ← 0,2 (mol)
mZn = 0,2.65 = 13 (g) => mCu = 15 – 13 = 2 (g)

Gọi hoá trị của X là n(n thuộc tập số nguyên dương)
Gọi chất rắn sau khi nung là Y.
Có: X dư, X2On.
\(n_{H_2}=\frac{1,12}{22,4}=0,2\left(mol\right)\)
PTHH: 4X + nO2 ---> 2X2On
2X + 2nHCl --------> 2XCln + nH2
Số mol X: \(\frac{0,6}{n}\left(mol\right)\)
Số mol O2: 0,15(mol)
Số molX(pt 2):\(\frac{0,1}{n}\left(mol\right)\)
Số mol XCln: 0,05(mol)
Ta có: nX= \(\frac{0,6}{n}+\frac{0,1}{n}=\frac{0,7}{n}\)
=> MX = \(\frac{6,3n}{0,7}\)đvC
Lập bảng biện luận
Cho n từ 1 ta thấy n=3 TM
=> M(X)=27
Vậy kim loại X là Al và CTHH của oxit là Al2O3.
#Walker
Thịnh Phạm
Gọi hoá trị của X là n.
Gọi chất rắn sau khi nung là Y. Trong Y có: X dư, X2On.
nH2 = 1.12/22.4=0.05 mol
PTHH: 4X + nO2 ---> 2X2On
\(\dfrac{0.6}{n}\) ......0.15
2X + 2nHCl --------> 2XCln + nH2
\(\dfrac{0.1}{n}\)...........................................0.05
Ta có: nX= \(\dfrac{0.6}{n}\) + \(\dfrac{0.1}{n}\) = \(\dfrac{0.7}{n}\) mol
=> MX = \(\dfrac{6.3}{\dfrac{0.7}{n}}\) đvC
Lập bảng biện luận
| n | 1 | 2 | 3 |
| MX | 9(loại) | 18(loại) | 27(Al) |
Vậy kim loại X là Al và CTHH của oxit là Al2O3.

Do khi pư HCl có khí thoát ra nên X dư sau pư với O2
2X + nO2 --> X2On
\(\frac{0.6}{n}\) 0.15 mol
2X + 2nHCl --> 2XCln +nH2
\(\frac{0.1}{n}\) 0.05 mol
Ta có
nX(dư) =\(\frac{6.3}{X}-\frac{0.6}{n}\) =\(\frac{0.1}{n}\) mol
=> X = 9n => n =9 thì X là Al




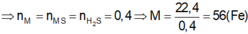
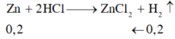
\(2R+2nHCl\rightarrow2RCl_n+nH_2\)
.0,12/n...............0,12/n......0,06......
\(R_2O_n+2nHCl\rightarrow2RCl_n+nH_2O\)
.0,3/n......................................0,3....
\(n_{H_2O}=2n_{O_2}=0,3\left(mol\right)\)
Có : \(m=13,44=m_R+m_{R_2O_n}=\dfrac{0,12R}{n}+\dfrac{\left(2R+16n\right)0,3}{n}\)
\(\Rightarrow R=12n\)
=> R là Mg
\(n_{Al\left(I\right)}=\dfrac{3}{2}n_{H_2}=0,045\left(mol\right)\)
\(n_{Al\left(II\right)}=2n_{Al_2O_3}=\dfrac{2}{3}n_{H_2O}=\dfrac{2}{3}.2n_{O_2}=\dfrac{4}{3}n_{O_2}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow m_{Al}=m=3,015\left(g\right)\)