Tổng số hạt trong nguyên tử y là 40 trong đó số hạt không mang điện tích nhiều hơn số hạt mang điện dương là 2 a) viết cấu hình e và xác định vị trí y trong bảng tuần hoàng b) xác định tính chất của y c) viết sự hình thành liên kết ion của nó
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1) a) \(Tacó:\left\{{}\begin{matrix}2Z+N=40\\2Z-N=12\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}Z=13\\N=14\end{matrix}\right.\\ \Rightarrow A=Z+N=13+14=27\)
b) Z=13 => X là Nhôm (Al)
c) Cấu hình e: \(1s^22s^22p^63s^23p^1\)
X thuộc ô 13, chu kỳ 3, nhóm IIIA
d) \(4Al+3O_2-^{t^o}\rightarrow2Al_2O_3\\Al+\dfrac{3}{2}Cl_2 -^{t^o}\rightarrow AlCl_3\\ 2Al+3S-^{t^o}\rightarrow Al_2S_3\\ Al+3HCl\rightarrow AlCl_3+\dfrac{3}{2}H_2\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)

có phải là hidroxit không , nếu v thì lm đc t thay hidro vào lm nha

gọi số prton,electron và notron của X lần lượt là :p,e,n
do p=e=> p+e=2p
theo đề ta có hpt: \(\begin{cases}2p+n=52\\2p=1,889n\end{cases}\)
<=> \(\begin{cases}p=17\\n=18\end{cases}\)
do p=17
=> x là Clo (Cl)
Cl nằm ở ô thứ 17 trong BTH

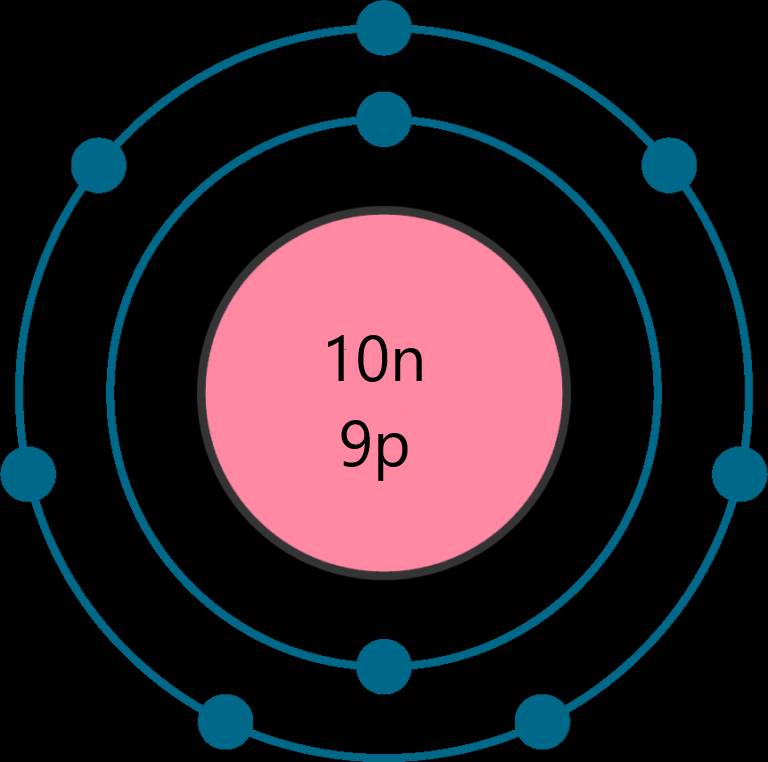
Tổng số các loại hạt là 28, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 8
⇒ Số neutron là 10 hạt
Số proton là 9 hạt
Số electron là 9 hạt
⇒ Nguyên tố Fluorine - ô số 9, chu kì 2, nhóm VIIA trong bảng tuần hoàn

1. Ta có tổng số hạt cơ bản của nguyên tố X là 36 , suy ra
p + e + n = 36 => 2p + n = 36
Số hạt mang điện gấp đôi số hạt không mang điện : 2p = 2n => p = n
Vậy : 3p = 36 => p = 12 => số p = số e = số z = 12
Số khối : A = p + n = 12 + 12 = 24
2.
a, Ta có tổng số hạt cơ bản là 54 hạt.
=> p+e+n=54 => 2p+n=54(1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 14
=> 2p-n=14(2)
Từ (1) và (2) ta có hệ pt:
2p-n=14
2p+n=54
<=> p=17
n=20
Vậy e=17, p=17, n=20
b, số hiệu nguyên tử Z=17
c, kí hiệu: Cl