Hòa tan hết 11,2g Cao vào nước,thu được 200ml dung dịch bazơ;a) Viết PTHH xảy ra;b)Tính nồng độ mol của dung dịch bazơ thu được;c)Đem dung dịch bazơ thu được ở trên trung hòa hết với V ml dung dịch H2SO4 15% có khối lượng riêng 1,05g/ml. tính V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hòa tan 9,4g một oxit kim loại hóa trị I vào H2O, thu được 200ml dung dịch Bazơ 1M.
Tìm oxit kim loại

PTHH: A2O + H2O → 2AOH
\(n_{AOH}\) = 0,2 ×1=0,2 ( mol ) ( vì 200 ml = 0,2 l )
Theo PT: \(n_{A_2O}=\dfrac{1}{2}n_{AOH}=\) = 12 × 0,2 = 0,1 ( mol )
⇒ \(M_{A_2O}=\dfrac{9,4}{0,1}=94\) ( G )
Ta có: 2\(M_A\) + 16 = 94
⇔ 2\(M_A\)= 78
⇔ \(M_A\) =39 ( g )
Vậy A là kim loại Kali K

\(n_{CaO}=\dfrac{6.72}{56}=0.12\left(mol\right)\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
\(0.12..........................0.12\)
\(m_{Ca\left(OH\right)_2}=0.12\cdot74=8.88\left(g\right)\)
\(C_{M_{Ca\left(OH\right)_2}}=\dfrac{0.12}{0.2}=0.6\left(M\right)\)
PTHH: \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
Ta có: \(n_{CaO}=\dfrac{6,72}{56}=0,12\left(mol\right)=n_{Ca\left(OH\right)_2}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Ca\left(OH\right)_2}=0,12\cdot74=8,88\left(g\right)\\C_{M_{Ca\left(OH\right)_2}}=\dfrac{0,12}{0,2}=0,6\left(M\right)\end{matrix}\right.\)

\(n_{Na_2O}=\dfrac{12,4}{62}=0,2mol\)
\(Na_2O+H_2O\rightarrow2NaOH\)
0,2 \(\rightarrow\) 0,2 \(\rightarrow\) 0,4
\(C_{M_{NaOH}}=\dfrac{0,4}{\dfrac{500}{1000}}=0,8M\)

Gọi a là KL CaO đã hoà tan thành dung dịch (a>0) (gam)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\\ Ta.được.dung.dịch.nước.vôi.trong.nồng.độ.là.0,2\%\\ \Rightarrow\dfrac{\dfrac{74}{56}a}{a+96\%.200}.100\%=0,2\%\\ \Leftrightarrow a\approx0,291\left(g\right)\)
\(\Rightarrow\%m_{\dfrac{CaO\left(tan\right)}{CaO\left(bđ\right)}}\approx\dfrac{0,291}{7}.100\approx4,16\%\)

200ml = 0,2l
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,2 0,2
\(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(C_{M_{FeCl2}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Chúc bạn học tốt

Số mol của canxi oxit
nCaO = \(\dfrac{m_{CaO}}{M_{CaO}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : CaO + H2O → Ca(OH)2\(|\)
1 1 1
0,2 0,2
Số mol của dung dịch canxi hidroxit
nCa(OH)2 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
500ml = 0,5l
Nồng độ mol của dung dịch canxi hidroxit
CMCa(OH)2 =\(\dfrac{n}{V}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)
Chúc bạn học tốt

Đáp án C
SO3+ H2O→ H2SO4
n H 2 S O 4 = n S O 3 = 0,1 mol; nH+= 0,2 mol; [H+]= 0,2/0,2=1M
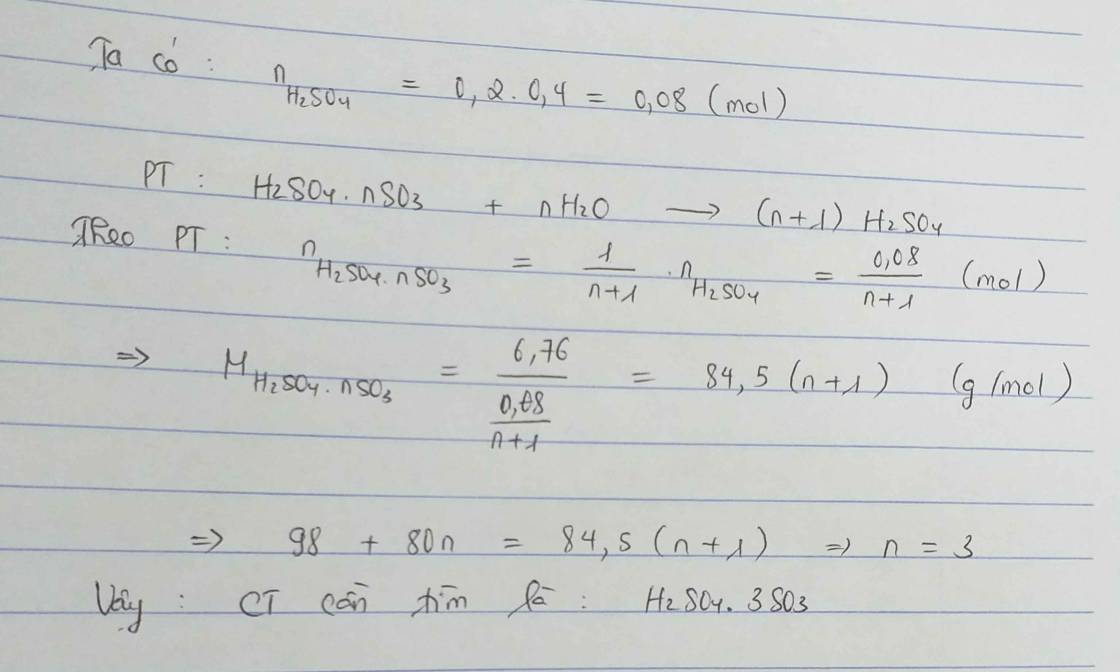
a, \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
b, \(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Ca\left(OH\right)_2}=n_{CaO}=0,2\left(mol\right)\Rightarrow C_{M_{Ca\left(OH\right)_2}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
c, \(Ca\left(OH\right)_2+H_2SO_4\rightarrow CaSO_4+2H_2O\)
Theo PT: \(n_{H_2SO_4}=n_{Ca\left(OH\right)_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,2.98}{15\%}=\dfrac{392}{3}\left(g\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{\dfrac{392}{3}}{1,05}\approx124,44\left(ml\right)\)
giúp e vs mn ơi ngày mai e thi rồi\