Cho cùng một lượng Zn hạt và Zn bột vào hai ống nghiệm 1 và 2. Sau đó, cho cùng một thể tích dung dịch HCl dư cùng nồng độ vào hai ống nghiệm. Dự đoán lượng Zn ở ống nghiệm nào sẽ tan hết trước.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nồng độ dung dịch HCl ở ống (2), (3) lớn hơn ở ống (1); diện tích tiếp xúc của bột Zn lớn hơn viên Zn hình cầu.
Chọn đáp án B

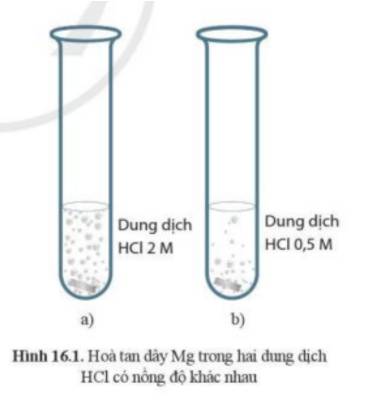
- Ở ống nghiệm (a) có hiện tượng sủi bọt khí nhiều hơn
=> Phản ứng ở ống nghiệm (a) xảy ra mãnh liệt hơn
=> Dây Mg ở ống nghiệm (a) sẽ bị tan hết trước
Mg + 2HCl → MgCl2 + H2↑

- Ta có phương trình: HCl + CaCO3 → CaCl2 + CO2↑ + H2O
=> Khi cho mẩu đá vôi tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là carbon dioxide
- Nồng độ HCl càng cao thì tốc độ phản ứng diễn ra càng nhanh.
- Giải thích: để phản ứng xảy ra, cần phải có sự va chạm giữa HCl và CaCO3. Ở ống nghiệm 2, nồng độ HCl lớn gấp đôi ở ống nghiệm 1, do vậy số va chạm của HCl và CaCO3 (trong cùng 1 đơn vị thời gian) sẽ lớn hơn, từ đó tốc độ phản ứng ở ống nghiệm 2 là lớn hơn

- Lượng bót khí thoát ra ở bình số 2 nhiều hơn bình số 1.
Nhận xét :
- Dd có nồng độ càng cao thì tốc độ phản ứng cao lên và mạnh hơn.
Giải thích :
Khi nồng độ tăng thì tốc độ phản ứng tăng. Do khi nồng độ các chất tham gia phản ứng tăng thì số phần tử hoạt động có trong một đơn vị thể tích tăng dẫn đến số va chạm có hiệu quả tăng → tốc độ phản ứng tăng.

- Đáp án C
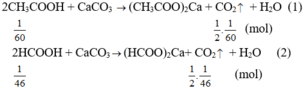
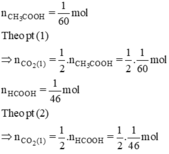
⇒ số mol CO2 thoát ra từ ống nghiệm hai nhiều hơn ống nghiệm thứ nhất.

Hiện tượng :
- Viên kẽm tan dần trong dd HCl loãng, có khí không màu thoát ra.
- Dấu hiệu chứng tỏ có phản ứng hoá học giữa HCl và Zn là mẩu Zn tan dần, có khí thoát ra.
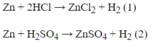
Dự đoán Zn ở ống nghiệm 2 (Zn dạng bột) sẽ tan hết trước do diện tích tiếp xúc với dung dịch HCl của Zn dạng bột lớn hơn của Zn dạng hạt.
Zn bột tan hết trước do diện tích tiếp xúc với dd HCl (dư) nhiều hơn -> Tốc độ p.ứ tăng