Hãy dự đoán số lượng của các đơn chất nhiều hơn hay ít hơn số lượng của các hợp chất. Giải thích.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


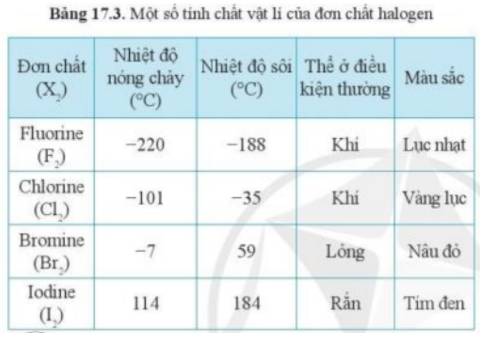
- Theo bảng 17.3, xu hướng biến đổi trạng thái của các halogen ở điều kiện thường từ: khí → lỏng → rắn
- Mà astatine đứng dưới cùng trong nhóm halogen
=> Astatine tồn tại ở thể rắn trong điều kiện thường
- Giải thích: Do sự tăng khối lượng phân tử và sự tăng tương tác van dể Waals

- Giá trị năng lượng liên kết của:
+ F – F trong phân tử F2: 159 kJ mol-1
+ N = N trong phân tử N2: 418 kJ mol-1
⟹ Năng lượng liên kết của F – F < N = N.
⟹ Liên kết của N2 bền hơn F2.
- Vậy phản ứng giữa F2 với H2 thuận lợi hơn (dễ xảy ra hơn) so với phản ứng giữa N2 với H2.

a) Giả sử lấy lượng mỗi chất là a gam
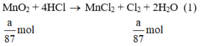
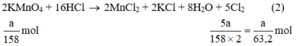
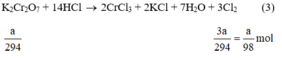
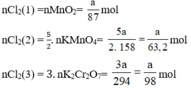
Ta có: 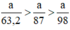
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 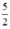 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.

Ta có phương trình hóa học :
1. BaCl2 + Na2SO4 \(\rightarrow\) 2NaCl + BaSO4
Những chất tham gia : BaCl2 và Na2SO4
Các chất sản phẩm : NaCl và BaSO4
Tổng khối lượng của các chất tham gia phản ứng và các chất sau phản ứng không thay đổi.
2. Tự làm

1/ chất tham gia : BaCl2, Na2SO4 sản phẩm tạo thành : BaSO4, NaCl
Sau phản ứng tổng kl của các chất tham gia phản ứng không đổi.
trước phản ứng 2 1 A B
2 1 A B Sau phản ứng thuyết trình thí nghiệm SGK trang 53![]()

Ta có: 1 amu = 1,6605 × 10-24 gam.
Với một nguyên tử/ phân tử có khối lượng là M (amu), ta có khối lượng mol nguyên tử/ phân tử đó là: M × 1,6605 × 10-24 × 6,022 × 1023 ≈ M (gam/ mol).
Vậy ta có điều cần chứng minh.

Các đơn chất là những chất chỉ được cấu tạo từ 1 NTHH
Còn các hợp chất được cấu tạo từ các nguyên tử của 2 nguyên tố hoá học trở lên liên kết với nhau.
=> Số lượng hợp chất nhiều hơn.