Đề: Cho 6,5 gam kẽm tác dụng với dung dịch loãng có chứa 10,95 gam axit clohdric. Sau khi phản ứng kết thúc người ta thu được 1 lượng khí hidro. Dẫn toàn bộ khí hidro thu được cho phản ứng hoàn toàn với bột đồng (II) oxit đun nóng được bột đồng và hơi nước.
a/Viết phản ứng hoá học xảy ra
b/Tính: thể tích khí hidro (dktc).
khối lượng đồng sinh ra.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1-------------->0,1------>0,1
\(\Rightarrow m_{ZnCl_2}=0,1.136=13,6\left(g\right)\)
b) \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c) \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
0,1<---0,1
\(\Rightarrow m_{CuO}=0,1.80=8\left(g\right)\)
a: Zn+2HCl->ZnCl2+H2
0,2 0,4 0,2 0,2
mZnCl2=0,2*136=27,2(g)
b: V=0,2*22,4=4,48(lít)

a,\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
0,1--------------->0,1------>0,1
b, => \(\left\{{}\begin{matrix}C_{M\left(ZnCl_2\right)}=\dfrac{0,1}{\dfrac{6}{1000}}=\dfrac{50}{3}M\\V_{H_2}=0,1.22,4=2,24\left(l\right)\end{matrix}\right.\)
c, \(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
LTL: \(\dfrac{0,1}{2}< 0,1\)=> O2 dư
Theo pt: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{O_2\left(dư\right)}=\left(0,1-0,05\right).32=1,6\left(g\right)\\V_{O_2\left(dư\right)}=\left(0,1-0,05\right).22,4=1,12\left(l\right)\end{matrix}\right.\)

a) \(n_{Fe}=\dfrac{1,12}{56}=0,02\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,02->0,02------------------>0,02
b) \(V_{H_2}=0,02.22,4=0,448\left(l\right)\)
c) \(C\%_{H_2SO_4}=\dfrac{0,02.98}{100}.100\%=1,96\%\)
d) \(n_{CuO}=\dfrac{0,8}{80}=0,01\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
LTL: 0,01 < 0,02 => H2 dư
Theo pthh: nCu = nCuO = 0,01 (mol)
=> mCu = 0,01.64 = 0,64 (g)

a)
\(Mg + H_2SO_4 \to MgSO_4 + H_2\\ n_{H_2} = n_{Mg} = \dfrac{3,6}{24} = 0,15(mol)\\ b)\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ n_{Cu} = n_{H_2} = 0,15(mol)\\ \Rightarrow m_{Cu} = 0,15.64 = 9,6(gam)\)

a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)

\(Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2\)
b)
\(n_{H_2}= \dfrac{2,24}{22,4}= 0,1 mol\)
\(\)Theo PTHH:
\(n_{ZnSO_4}= n_{H_2}= 0,1 mol\)
\(m_{ZnSO_4}= 0,1 . 161=16,1g\)
c)
Theo PTHH:
\(n_{H_2SO_4}= n_{H_2}= 0,1 mol\)
\(\Rightarrow m_{H_2SO_4}= 0,1 . 98= 9,8g\)
\(\Rightarrow m_{dd H_2SO_4}= \dfrac{9,8 . 100}{20}=49g\)
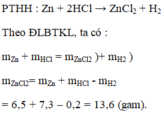
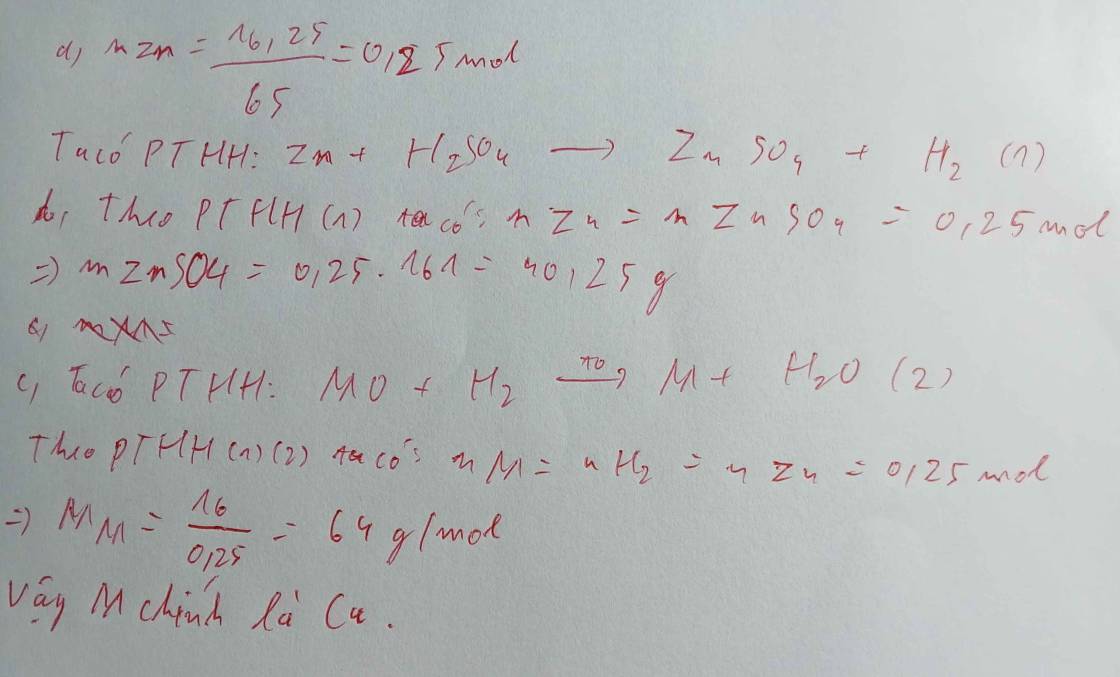
`a)PTHH:`
`Zn + 2HCl -> ZnCl_2 + H_2 \uparrow`
`0,1` `0,2` `0,1` `(mol)`
`H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,1` `0,1` `(mol)`
`n_[Zn]=[6,5]/65=0,1(mol)`
`n_[HCl]=[10,95]/[36,5]=0,3(mol)`
Ta có: `[0,1]/1 < [0,3]/2`
`=>HCl` dư
`b)V_[H_2]=0,1.22,4=2,24(l)`
`m_[Cu]=0,1.64=6,4(g)`