Đốt một hỗn hợp khí gồm metan và etilen có thể tích 6,72 lít ( đktc). Dẫn sản phẩm cháy vào dung dịch nước vôi trong. Sau phản ứng thu được 50g chất kết tủa. Dung dịch sau phản ứng làm quỳ tím chuyển sang màu xanh. Tính phần trăm về thể tích của mỗi khí trong hỗn hợp.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1 :
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CaCO_3} = n_{CO_2} = n_{CH_4} = \dfrac{5,6}{22,4} = 0,25(mol)\\ m_{CaCO_3} = 0,25.100 = 25(gam)\)

a)
CH4 + 2O2 --to--> CO2 + 2H2O
C2H4 + 3O2 --to--> 2CO2 + 2H2O
b) Gọi số mol CH4, C2H4 là a, b (mol)
=> \(a+b=\dfrac{6,72}{22,4}=0,3\)
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
Khí thoát ra khỏi bình là CH4
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a---------------->a
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,2<------0,2
=> a = 0,2 (mol)
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,2}{0,3}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
c) b = 0,1 (mol)
CH4 + 2O2 --to--> CO2 + 2H2O
0,2--------------->0,2----->0,4
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,1----------------->0,2---->0,2
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,4------>0,4
=> \(m_{CaCO_3}=0,4.100=40\left(g\right)\)
\(\left\{{}\begin{matrix}m_{CO_2}=44\left(0,2+0,2\right)=17,6\left(g\right)\\m_{H_2O}=\left(0,4+0,2\right).18=10,8\left(g\right)\end{matrix}\right.\)
Xét \(\Delta m=m_{CO_2}+m_{H_2O}-m_{CaCO_3}=17,6+10,8-40=-11,6\left(g\right)\)
=> Khối lượng dd giảm 11,6 gam

\(\left\{{}\begin{matrix}CH_4:x\left(mol\right)\\C_2H_4:y\left(mol\right)\end{matrix}\right.\)⇒ x + y = \(\dfrac{8,96}{22,4} = 0,4\)(1)
\(m_{CO_2} + m_{H_2O} = m_{bình\ tăng} = 45,2(gam)\)
Bảo toàn nguyên tố với C:\(n_{CO_2} = x + 2y(mol)\)
Bảo toàn nguyên tố với H:\(n_{H_2O} = 2x + 2y (mol)\)
Suy ra :(x + 2y).44 + (2x+2y).18 = 45,2(2)
Từ (1)(2) suy ra: x = 0,1 ; y = 0,3
Vậy :
\(\%V_{CH_4} = \dfrac{0,1}{0,4}.100\% = 25\%\\ \%V_{C_2H_4} = 100\% - 25\% = 75\%\\ CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CaCO_3} = n_{CO_2} = 0,1 + 0,3.2 = 0,7(mol)\\ \Rightarrow m = 0,7.100 = 70(gam)\)

Gọi số mol C 2 H 2 và C 2 H 4 trong hỗn hợp là x, y.
Ta có x + y = 6,72/22,4 = 0,3 mol
2 C 2 H 2 + 5 O 2 → 4C O 2 + 2 H 2 O
C 2 H 4 + 3 O 2 → 2C O 2 + 2 H 2 O
Theo phương trình hoá học của phản ứng cháy, ta có :
n CO 2 = 2x + 2y => m CO 2 = 44(2x + 2y)
n H 2 O = x + 2y → m H 2 O = 18 (x + 2y)
Theo đề bài, khối lượng bình Ca OH 2 tăng lên chính là khối lượng của C O 2 và H 2 O . Vậy :
m CO 2 + m H 2 O = 44(2x + y) + 18 (x + 2y) = 33,6g
Ta có các phương trình : x + y = 0,3
106x + 124y = 33,6
Giải ra ta được : x = 0,2 ; y = 0,1.
% V C 2 H 2 = 0,2x22,4/6,72 x 100% = 66,67%
% V C 2 H 4 = 33,33%
n CO 2 = 2(x+y) = 0,6 mol = n CaCO 3
m CaCO 3 = 0,6 x 100 = 60g

Đáp án : B
nCaCO3 = nCO2 = 1 mol
mgiảm = mCaCO3 – ( mCO2 + mH2O )
=> nH2O = 0,9 mol
=> nC(A) = 1 mol ; nH(A) = 1,8 mol
Do A gồm toàn hidrocacbon => mA = mC + mH
=> m = 12.1 + 1.1,8 = 13,8g

nBr2 = 0,125 mol
Khi đốt cháy nA = 0,25 mol
mNaOH ban đầu = 36g => nNaOH = 0,9 mol
Gọi x, y lần lượt là số mol của CO2 và H2O
mdd = 180 + 44x + 18y
Vì NaOH dư do đó chỉ tạo muối trung hòa
CO2 +2NaOH → Na2CO3 + H2O
x 2x
nNaOH dư = 0,9 – 2x
có 2 , 75 % = 40 ( 0 , 9 - 2 x ) 180 + 44 x + 18 y . 100 % (1)
=> 81,21x + 0,495y = 31,05n
2,8 lít khí A tác dụng với 0,125 mol Br2
=> 5,6 lít khí A tác dụng với 0,25 mol Br2
Gọi số mol khí của CH4, C2H4 và C2H2 lần lượt là a; b; c
Ta có a + b + c = 0,25 mol
Và b + 2c = 0,25
=> a = c
=> khi đốt cháy hỗn hợp A cho nCO2 = nH2O
Thay vào (1) => x = y = 0,38 mol
Bảo toàn C, H khi đốt cháy ta có
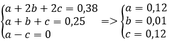
=> %VCH4 = %VC2H2 = 48%
%VC2H4 = 4%

Chọn D
C2H2 + AgNO3 -> Ag2C2↓
=> nkết tủa = nC2H2 =0,04 mol
,mbình tăng = mC2H2 + mC2H4 = 2,72g => nC2H4 = 0,06 mol
Đốt cháy : nCO2 = 2nC2H2 + 2nC2H4 = 0,2 mol
nOH = 0,15 mol < nCO2
=> phản ứng chỉ tạo HCO3 với số mol là 0,15 mol
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\)
=> \(a+b=\dfrac{6,72}{22,4}=0,3\left(mol\right)\) (1)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a----------------->a
C2H4 + 3O2 --to--> 2CO2 + 2H2O
b------------------->2b
=> nCO2 = a + 2b (mol)
Do dd sau pư làm quỳ tím chuyển màu xanh
=> Ca(OH)2 dư
\(n_{CaCO_3}=\dfrac{50}{100}=0,5\left(mol\right)\)
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
0,5<-----0,5
=> a + 2b = 0,5 (2)
(1)(2) => a = 0,1 (mol); b = 0,2 (mol)
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,3}.100\%=33,33\%\\\%V_{C_2H_4}=\dfrac{0,2}{0,3}.100\%=66,67\%\end{matrix}\right.\)