Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(n_{Mg}=\dfrac{7,2}{24}=0,3mol\)
\(\rightarrow0,3molH_2\)\(\rightarrow V_{H2}=0,3.22,4=6,72l\)
b)\(H_2+Fe_2O_3\rightarrow3H_2O+2Fe\)
\(n_{Fe2O3}=\dfrac{19,2}{160}=0,12mol\)
\(\rightarrow0,24molFe\rightarrow m_{Fe}=0,24.56=13,44gam\)

nMg = 7,2/24 = 0,3 (mol)
PTHH: Mg + 2HCl -> MgCl2 + H2
Mol: 0,3 ---> 0,6 ---> 0,3 ---> 0,3
VH2 = 0,3 . 22,4 = 6,72 (l)
nFe = 19,2/160 = 0,12 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
LTL: 0,12 > 0,3/3 => Fe2O3 dư
nFe = 0,3 : 3 . 2 = 0,2 (mol)
mFe = 0,2.56 = 11,2 (g)
\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
1 2 1 1
0,3 0,6 0,3 0,3
a/ \(V_{H_2\left(đktc\right)}=n.22,4=0,3.22,4=6.72\left(l\right)\)
b/ \(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
PTHH: \(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
1 3 2 3
0,12 0,3
-Chuyển thành tỉ lệ: \(\dfrac{0,12}{1}>\dfrac{0,3}{3}\)
\(\Rightarrow\)H2 phản ứng hết còn Fe2O3 dư.
-Theo PTHH trên: \(n_{Fe}=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe}=n.M=0,2.56=11,2\left(g\right)\)

Giải thích các bước giải:
a) Mg +H2SO4--->MGSO4+H2
n Mg =6/24=0,25(mol)
n H2=n Mg =0,25(mol)
V H2=0,25.22,4=5,6(l)
b) 3H2+FE2O3-->2Fe+3H2O
n Fe2O3=32/160=0,2(mol)
->Fe2O3 dư
n Fe =2/3n H2=1/6(mol)
m Fe =1/6.56=28/3(g)
\(a,n_{Mg}=\dfrac{6}{24}=0,25\left(mol\right)\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ n_{H_2}=n_{Mg}=0,25\left(mol\right)\\ V_{H_2\left(\text{đ}ktc\right)}=0,25.22,4=5,6\left(l\right)\\ b,n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\\ 3H_2+Fe_2O_3\rightarrow\left(t^o\right)2Fe+3H_2O\\ n_{Fe}=2.n_{Fe_2O_3}=2.0,2=0,4\left(mol\right)\\ m_{Fe}=0,4.56=22,4\left(g\right)\)

\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH :
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,3 0,3
\(a,V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(b,PTHH:\)
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
trc p/u: 0,3 0,12
p/u: 0,3 0,1 0,2 0,3
sau : 0 0,02 0,2 0,3
----> Fe2O3 dư
\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
\(n_{Fe}=0,2.56=11,2\left(g\right)\)

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{1}{15}\left(mol\right)\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)

PTHH: Zn + 2HCl → ZnCl2 + H2 ↑
Số mol của Zn là: 19,5 : 65 = 0,3 mol
Số mol của H2 là: 0,3 . 1 = 0,3 mol
a) Thể tích H2 thu được là: 0,3 . 22,4 = 6,72 lít
b) PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Số mol của Fe2O3 là: 19,2 : 160 = 0,12 mol
So sánh: \(\frac{0,3}{3}< 0,12\) => Fe2O3 dư, tính theo H2
Số mol của Fe là: 0,3 . 2/3 = 0,2 mol
Khối lượng Fe là: 0,2 . 56 = 11,2 gam
nZn=19,5:65=0,3mol
PTHH: Zn+2HCl=>ZnCl2+H2
0,3->0,6->0,3->0,3
=> V H2=0,3.22,4=6,72ml
thu đc bao nhiêu gam j

a) nAl=2,7/27=0,1(mol)
nHCl=14,6/36,5= 0,4(mol)
PTHH: 2Al +6 HCl -> 2 AlCl3 +3 H2
Ta có: 0,1/2 < 0,6/4
=> HCl dư, Al hết, tính theo nAl
=> nAlCl3=nAl=0,1(mol)
=> mAlCl3=0,1.133,5=13,35(g)
b) nH2= 3/2. nAl=3/2. 0,1=0,15(mol)
=>V(H2,đktc)=0,15.22,4=3,36(l)
c) mFe2O3(nguyên chất)= 80%. 38,4=30,72(g)
=>nFe2O3= 30,72/160=0,192(mol)
PTHH: Fe2O3 + 3 H2 -to->2 Fe +3 H2O
Ta có: 0,192/1 > 0,15/3
=> H2 hết, Fe2O3 dư, tính theo nH2
=> nFe= 2/3. nH2= 2/3. 0,15=0,1(mol)
=>mFe=0,1.56=5,6(g)
a,\(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right);n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2
Mol: 0,1 0,1 0,15
Tỉ lệ:\(\dfrac{0,1}{2}< \dfrac{0,4}{6}\) ⇒ Al pứ hết,HCl dư
\(\Rightarrow m_{AlCl_3}=0,1.133,5=13,35\left(g\right)\)
b,\(V_{H_2}=0,15.22,4=3,36\left(l\right)\)
c,\(m_{Fe_2O_3\left(tinhkhiét\right)}=38,4.\left(100\%-20\%\right)=30,72\left(g\right)\)
⇒\(n_{Fe_2O_3}=\dfrac{30,72}{160}=0,192\left(mol\right)\)
PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Mol : 0,15 0,1
Tỉ lệ:\(\dfrac{0,192}{1}>\dfrac{0,15}{3}\)⇒ Fe2O3 dư,H2 hết
=> mFe = 0,1.56 =5,6 (g)

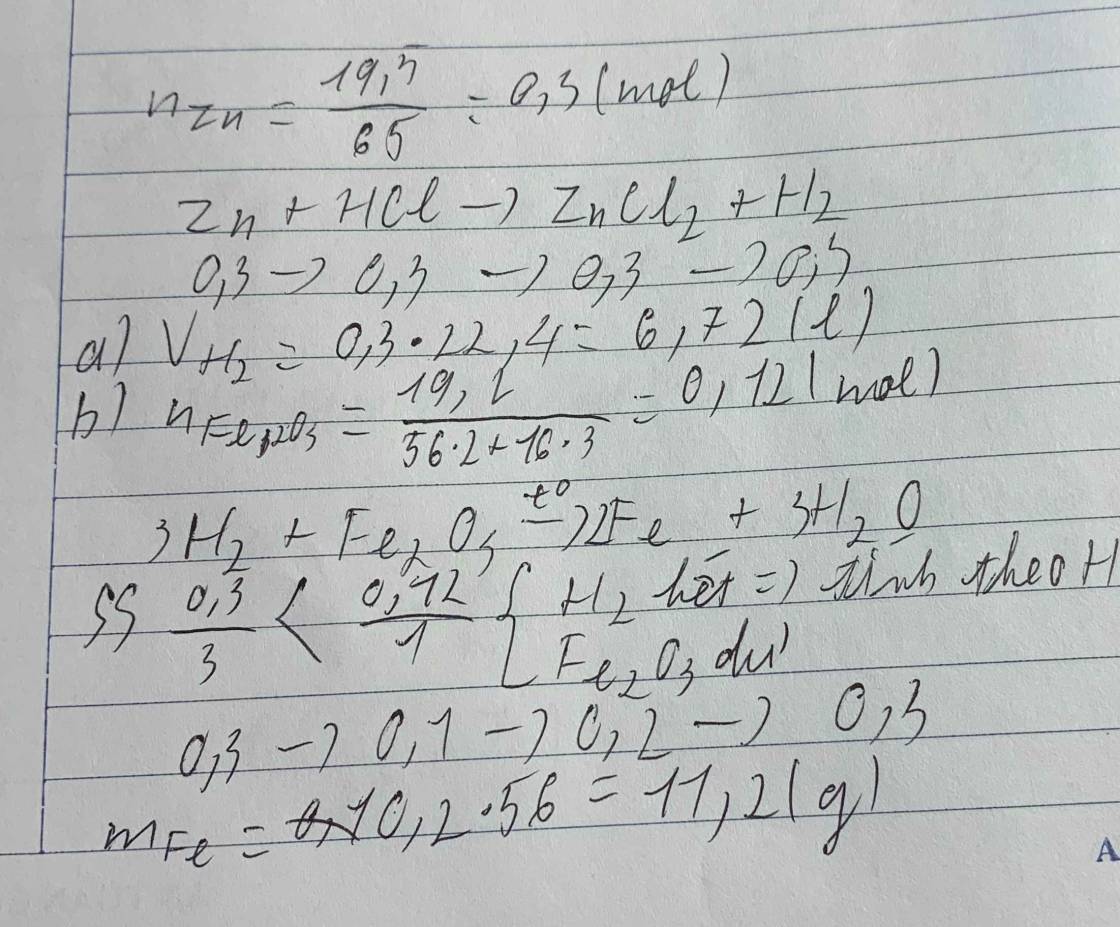
a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Ta có: \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, PT: \(Fe_2O_3+3H_2O\underrightarrow{t^o}2Fe+3H_2O\)
Ta có: \(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,12}{1}>\dfrac{0,3}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,2.56=11,2\left(g\right)\)
Bạn tham khảo nhé!