Cho MnO2 tác dụng hoàn toàn với 20g dd HCl 36,5%. Khí thoát ra được hấp thụ hết vào 500ml dd KOH 2M ở nhiệt độ thường tạo ra dd A. Tính nồng độ mol chất tan trong dd A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
nKOH = 0,5.4 = 2(mol)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,8------------------------>0,8
2KOH + Cl2 --> KCl + KClO + H2O
Xét tỉ lệ \(\dfrac{2}{2}>\dfrac{0,8}{1}\) => KOH dư, Cl2 hết
2KOH + Cl2 --> KCl + KClO + H2O
1,6<--0,8---->0,8---->0,8
=> \(\left\{{}\begin{matrix}n_{KOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{KCl}=0,8\left(mol\right)\\n_{KClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(KOH\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(KCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(KClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)

35. Cho 15g MnO2 ( chứa 13% tạp chất trơ) tác dụng hết với dd HCl đặc dư , khí thoát ra đc hấp thụ hết vào 400ml dd NaOH 1M ở nhiệt độ thường. Tổng nồng độ mol /l của muối tạo thành?
----
mMnO2= (100%-13%).15=13,05(g)
=>nMnO2= 13,05/87=0,15(mol)
nNaOH= 1.0,4= 0,4(mol)
PTHH: MnO2 + 4 HCl(đ) -to-> MnCl2 + Cl2 + 2 H2O
0,15_________0,6_________0,15___0,15(mol)
Cl2 + 2 NaOH \(\leftrightarrow\) NaCl + NaClO + H2O
0,15_0,3_____0,15____0,15(mol)
Ta có: 0,4/2 > 0,15/1
=> Cl2 hết, NaOH dư, tính theo nCl2
Vddsau= VddNaOH= 0,4(l)
Tổng nồng độ mol dung dịch muối tạo thành:
\(C_{MddNaCl}+C_{MddNaClO}=\frac{0,15}{0,4}+\frac{0,15}{0,4}=0,75\left(M\right)\)

MnO 2 + HCl → MnCl 2 + Cl 2 + 2 H 2 O
Cl 2 + 2NaOH → NaCl + NaClO + H 2 O
n MnO 2 = 0,2 mol; n NaOH = 0,729 mol
Theo phương trình (1) ta có: n Cl 2 = n MnO 2 = 0,2 mol
Theo phương trình (2) ta có: 2 n Cl 2 < n NaOH ⇒ NaOH dư
Dung dịch A gồm: n NaCl = n NaClO = n Cl 2 = 0,2 mol
n NaOH dư = 0,729 – 2.0,2 = 0,329 mol
m dd A = m Cl 2 + m dd NaOH = 0,2.71 + 145,8 = 160g
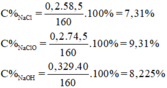

nCO2 = \(\dfrac{6,72}{22,4}\)= 0,3 mol
nKOH = 0,2.2 = 0,4 mol
\(\dfrac{nKOH}{nCO_2}\) = \(\dfrac{4}{3}\)>1 => tạo 2 muối CO32- và HCO3-
CO2 + 2KOH --> K2CO3 + H2O
CO2 + KOH --> KHCO3
Đặt số mol K2CO3 và KHCO3 thu được lần lượt là x và y mol ta có hệ :
\(\left\{{}\begin{matrix}x+y=0,3\\2x+y=0,4\end{matrix}\right.\)=> x = 0,1 ,y = 0,2
CK2CO3 = \(\dfrac{n}{V}\)= \(\dfrac{0,1}{0,2}\)= 0,5 M
CKHCO3 = \(\dfrac{0,2}{0,2}\)= 1M

Phản ứng xảy ra:
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
Ta có:
\(n_{MnO2}=\frac{13,05}{55+16.2}=0,15\left(mol\right)\)
\(\Rightarrow n_{Cl2}=n_{MnO2}=0,15\left(mol\right)\)
\(2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
Vì \(n_{NaOH}=0,5.1=0,5\left(mol\right)>2nCl_2\)
Nên NaOH dư.
\(\Rightarrow n_{NaCl}=n_{NaClO}=n_{Cl2}=0,15\left(mol\right)\)
\(n_{NaOH\left(Dư\right)}=0,5-0,15.2=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}CM_{NaCl}=\frac{0,15}{0,5}=0,3M\\CM_{NaClO}=\frac{0,15}{0,5}=0,3M\\CM_{NaOH\left(dư\right)}=\frac{0,2}{0,5}=0,4M\end{matrix}\right.\)


MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
nHCl = \(\dfrac{20.36,5\%}{36,5}\)= 0,2 mol => nCl2 = 0,2 : 4 = 0,05 mol
Cl2 + 2KOH →KCl + KClO + H2O
nKOH = 0,5.2 = 1 mol
=> KOH dư , Cl2 hết
nKOH dư = 1 - 0,05.2 = 0,9 mol
dung dịch A gồm KCl và KClO có số mol = nCl2 = 0,05 mol và KOH dư 0,9mol
CKCl = CKClO = \(\dfrac{0,05}{0,5}\)=0,1 M
CKOH dư = \(\dfrac{0,9}{0,5}\)= 1,8 M