Cho 18,8 gam phenol vào 100 gam nước khuấy đều thì thu được hỗn hợp đục như sữa (hỗn hợp A). Đun nóng tới 70oC thì trở thành dung dịch trong. Cho Na2CO3 vào hỗn hợp A thì thu được dung dịch trong suốt. Sục khí CO2 vào dung dịch đó thì lại thấy vẩn đục.a. Giải thích các hiện tượng trên.b. Tính thể tích tối thiểu dung dịch Na2CO3 1M cần dùng để làm trong hỗn hợp A, biết độ tan của phenol trong điều kiện thí nghiệm này là 6,3 gam trong 100 gam nước.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe= a mol
n FeO= b mol
Ta có 56a+72b=18,8 (1)
2Fe+ 6H2SO4(đ)-> Fe2(SO4)3 +3SO2+6H2O
a. 1,5a
2FeO +4H2SO4(đ)-> Fe2(SO4)3 +SO2+4H2O
b. 0,5b
Mặt khác ta có
Fe+H2SO4(l)-> FeSO4+H2
a. a
FeO+H2SO4-> FeSO4+H2O
a=nH2=1,12/22,4=0,05
Từ (1)=>b=0,222mol
=> nSO2=1,5a+0,5b= 0,186mol
V(SO2)=4,1664LIT
B, %mFe= 0,05.56.100%/18,8=14,9%
mFeO= 18,8-,05.56=16g
=> %mFeO = 16.100%/18,8=85,1%

- Phần 1:
\(n_{Ag}=\dfrac{2,16}{108}=0,02\left(mol\right)\)
PTHH: \(C_6H_{12}O_6+Ag_2O\rightarrow C_6H_{12}O_7+2Ag\downarrow\)
0,01<---------------------------------0,02
\(\rightarrow m_{C_6H_{12}O_6}=0,01.180=1,8\left(g\right)\)
- Phần 2:
\(n_{Ag}=\dfrac{6,48}{108}=0,06\left(mol\right)\)
PTHH:
\(C_6H_{12}O_6+Ag_2O\underrightarrow{NH_3}C_6H_{12}O_7+2Ag\downarrow\)
0,03<-----------------------------------0,06
\(\left(C_6H_{10}O_5\right)_n+nH_2O\underrightarrow{H_2SO_4\left(loãng\right)}nC_6H_{12}O_6\)
0,02<----------------------------------------0,02
\(\rightarrow m_{tinh.bột}=0,02.162=3,24\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_{C_6H_{12}O_6}=\dfrac{1,8}{3,24+1,8}.100\%=35,71\%\\\%m_{tinh.bột}=100\%-35,71\%=64,29\%\end{matrix}\right.\)

Chọn D
n(ancol) = n(NaOH) = 0,24 mol → n(ancol phản ứng) = 0,24*80% = 0,192 mol
→ n(este) = n(H2O) =0,096 → m(ancol phản ứng) = m(ete) + m(H2O) = 6,816
→ M (ancol) = 35,5 → 2 ancol là CH3OH (0,18 mol) và C2H5OH (0,06 mol)
Trong E: n(H2O) = 0,66 mol → n(H) = 1,32 n(O) = 2n(NaOH) = 0,48 → n(C) = 0,66
Vậy đốt E thu được sản phẩm có n(CO2) = n(H2O) → E chứa các este no, đơn chức.
Số C = 0,66/0,24 = 2,75 → X là HCOOCH3
TH1: Y và Z đều có dạng RCOOC2H5
n(X) = 0,18, n(Y) + n(Z) = 0,06
n(CO2) = 0,18*2 + 0,06n = 0,66 → n = 5 (Loại vì Y, Z trùng nhau)
TH2: X là HCOOCH3 (a), Y là RCH2COOCH3 (b) và Z là RCOOC2H5 (0,06)
→ n(CH3OH) = a + b =0,18 mol
→ m(khí) = 2a + (R+15)b + (R+1)*0,06 = 0,24*9 → Rb + 13b + (R+1)*0,06 = 1,8
→ 0,06(R+1) < 1,8 → R < 29 → R = 15 → a = 0,15 và b = 0,03
Vậy các chất trong R:
X: HCOOCH3 (0,15 mol); Y: C2H5COOCH3 (0,03 mol); Z: CH3COOC2H5 (0,06)
%X = 53,19%

Quỵ đổi X thành:
C 2 H 3 O N : 0 , 22 (Tính từ n N 2 = 0 , 22 )
C H 2 : a m o l H 2 O : b m o l
Trong phản ứng thủy phân M:
X + NaOH → Muối + H 2 O
m N a O H − m H 2 O = 7 , 9 = > 40.0 , 22 − 18 b = 7 , 9 = > b = 0 , 05
Đốt muối thu được:
n N a 2 C O 3 = n NaOH 2 = 0 , 11 m o l
Bảo toàn C: n C O 2 = 0 , 22.2 + a − 0 , 11 = a + 0 , 33
Bảo toàn H: n H 2 O = 0 , 22.1 , 5 + a + b + 0 , 22 2 – b = a + 0 , 44
=> 44.(a + 0,33) + 18.(a + 0,44) = 28,02 => a = 0,09 => m A = 14 , 7 g a m
Đặt x, y là số mol X, Y = > n A = x + y = b = 0 , 05 v à n N a O H = 4 x + 5 y = 0 , 22
=> x = 0,03 và y = 0,03
Đặt u, v là số mol của Gly và Ala
= > n N = u + v = 0 , 22 v à n C = 2 u + 3 v = n C O 2 + n N a 2 C O 3 = 0 , 53 n
=> u = 0,13 và v = 0,09
X : G l y p A l a 4 − p Y : G l y q A l a 5 − q
= > n G l y = 0 , 03 p + 0 , 02 q = 0 , 13 = > 3 p + 2 q = 13
Vì p < 4 và q < 5 => p = 3 và q = 2 => X là G l y 3 A l a
= > % X = 0 , 03.260 14 , 7 = 53 , 06 %
=> %Y = 46,94%
Đáp án cần chọn là: A

\(n_{BaSO_4}=\dfrac{356,49}{233}=1,53\left(mol\right)\)
=> \(n_{KHSO_4}=1,53\left(mol\right)\)
=> \(n_{Fe\left(NO_3\right)_3}=\dfrac{216,55-1,53.136}{242}=0,035\left(mol\right)\)
\(n_{H_2}=\dfrac{2,016.4}{9.22,4}=0,04\left(mol\right)\)
\(n_{N_2O}=\dfrac{1.2,016}{9.22,4}=0,01\left(mol\right)\)
\(n_{NO_2}=\dfrac{1.2,016}{9.22,4}=0,01\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{N_2}+n_{NO}=\dfrac{2,016}{22,4}-0,04-0,01-0,01=0,03\left(mol\right)\\m_{N_2}+m_{NO}=1,84-2.0,04-44.0,01-46.0,01=0,86\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{N_2}=0,02\left(mol\right)\\n_{NO}=0,01\left(mol\right)\end{matrix}\right.\)
Bảo toàn N: \(n_{NH_4^+}=0,025\left(mol\right)\)
Bảo toàn H: \(n_{H_2O}=\dfrac{1,53-0,04.2-0,025.4}{2}=0,675\left(mol\right)\)
Bảo toàn O: \(4.n_{KHSO_4}+9.n_{Fe\left(NO_3\right)_3}+n_{O\left(B\right)}=n_{H_2O}+n_{NO}+2n_{NO_2}+n_{N_2O}+4.n_{BaSO_4}\)
=> nO(B) = 0,4 (mol)
=> \(m_B=\dfrac{0,4.16.205}{64}=20,5\left(g\right)\)
=> B
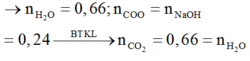
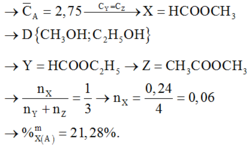
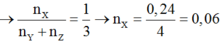
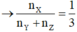
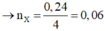
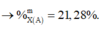
giúp mình làm bài này với