Nén đẳng nhiệt một lượng khí từ thể tích 12 lít đến thể tích 8 lít thì thấy áp suất của khí tăng lên một lượng 20 Pa. Áp suất ban đầu của khí là
A. 60 Pa.
B. 20 Pa.
C. 10 Pa.
D. 40 Pa.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B.
Vì quá trình biến đổi là đẳng nhiệt nên ta có:
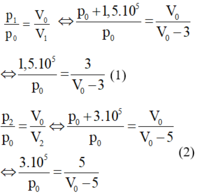
Từ (1) và (2), ta tìm được p 0 = 6 . 10 5 Pa; V 0 = 15 lít.

Chọn B.
Vì quá trình biến đổi là đẳng nhiệt nên ta có:
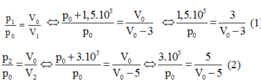
Từ (1) và (2), ta tìm được p0 = 6.105 Pa; V0 = 15 lít.

Chọn B.
Vì quá trình biến đổi là đẳng nhiệt nên ta có:
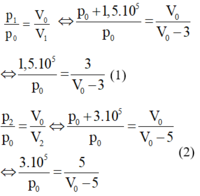
Từ (1) và (2), ta tìm được p0 = 6 . 10 5 Pa; V0 = 15 lít

Áp suất lúc sau:
\(p_2=p_1-\Delta p\Rightarrow p_1=p_2+0,4\left(atm\right)\)
Quá trình đẳng nhiệt:
\(p_1V_1=p_2V_2\)
\(\Rightarrow\left(p_2+0,4\right)\cdot8=p_2\cdot10\)
\(\Rightarrow p_2=1,6atm\Rightarrow p_1=1,6+0,4=2atm\)
Chọn C

Chọn B.
Áp dụng công thức nguyên lí I NĐLH: ∆U = A + Q
Vì chất khí thực hiện công nên A = -p.∆V
= -1,5. 10 5 .(60. 10 - 3 – 40. 10 - 3 ) = 3000J.
Khi tăng nội năng một lượng là 4,28 J nên ∆U = 4,28 J
Do đó: Q = ∆U - A = 4,28 + 3000 = 3004,28J.

Phương trình trạng thái khí lí tưởng: \(\dfrac{P.V}{T}=\text{const}\)
Suy ra: \(\dfrac{P_1.V_1}{T_1}=\dfrac{P_2.V_2}{T_2}\)
\(\Rightarrow T_2=\dfrac{P_2.V_2}{P_1.V_1}.T_1=\dfrac{7.10^5}{0,8.10^5.5}.(273+50)=565.25K\)
\(\Rightarrow t_2=565,25-273=292,25^0C\)

Chọn B.
Áp dụng công thức nguyên lí I NĐLH: ∆U = A + Q
Vì chất khí thực hiện công nên A = -p.∆V = -1,5.105.(60.10-3 – 40.10-3) = 3000J.
Khis tăng nội năng một lượng là 4,28 J nên ∆U = 4,28 J
Do đó: Q = ∆U - A = 4,28 + 3000 = 3004,28J.
Chọn D.
Áp dụng định luật Bôi-lơ – Ma-ri-ốt, ta có p1V1 = p2V2
Suy ra p1 = 40 Pa.