Cho 1,53 gam hỗn hợp Ba, Mg, Fe và Zn vào dung dịch HCl dư thấy thoát ra 448 ml khí (đktc). Cô cạn hỗn hợp sau phản ứng thì thu được chất rắn có khối lượng là
A. 2,24 gam
B. 2,95 gam
C. 1,85 gam
D. 3,90 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Cho hỗn hợp chất rắn phản ứng với HCl dư có Cu không phản ứng.
Phương trình hóa học:
F e + 2 H C l → F e C l 2 + H 2 F e O + 2 H C l → F e C l 2 + H 2 O


\(n_{H_2}=\dfrac{0,336}{22,4}=0,015mol\)
\(\Rightarrow n_{HCl}=2n_{H_2}=2\cdot0,015=0,03mol\)
\(\Rightarrow n_{Cl^-}=0,03mol\Rightarrow m_{Cl^-}=1,065g\)
\(m_{CRắn}=m_{kl}+m_{Cl^-}=1,065+1,5=2,565g\)

12,1 gam (Fe, Zn) + HCl (vừa đủ) → muối FeCl 2 , ZnCl 2 + H 2

Đáp án là C

a)
$4Na + O_2 \xrightarrow{t^o} 2Na_2O$
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$2Na + 2HCl \to 2NaCl + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
b)
Bảo toàn khối lượng : $m_{O_2} = 4,08 - 2,48 = 1,6(gam)$
$n_{O_2} = \dfrac{1,6}{32} = 0,05(mol)$
Đốt 2,48 gam X cần 0,05 mol $O_2$
Suy ra, đốt 4,96 gam X cần 0,1 mol $O_2$
Mà : \(\dfrac{1}{4}n_{Na}+\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}=n_{O_2}=0,1\)
Theo PTHH :
\(n_{H_2}=\dfrac{1}{2}n_{Na}+n_{Mg}+\dfrac{3}{2}n_{Al}=2\left(\dfrac{1}{4}n_{Na}+\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}\right)=2.0,1=0,2\)$V = 0,2.22,4 = 4,48(lít)$
$n_{HCl} = 2n_{H_2} = 0,4(mol)$
Bảo toàn khối lượng : $m = 4,96 + 0,4.36,5 - 0,2.2 = 19,16(gam)$

Đáp án A
Khối lượng chất rắn tăng = mCl đi vào muối
Vì khi tăng HCl thì khối lượng chất rắn tăng => thí nghiệm đầu chắc chắn kim loại dư
=> 34,575 – 18,6 = 35,5.0,5x => x = 0,9
=> nCl muối sau = 0,6 mol < nHCl sau = 0,72 mol => HCl dư
=> nFe + nZn = ½ nCl muối = 0,3 mol và 56nFe + 65nZn = 18,6g
=> nFe = 0,1 => mFe = 5,6g
=>A

Định hướng tư duy giải
Ta có:
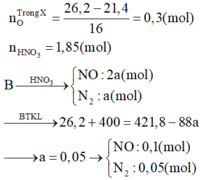

Chất tan trong bình gồm hỗn hợp muối và HNO3 dư.
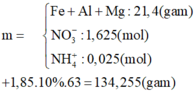
Chọn B