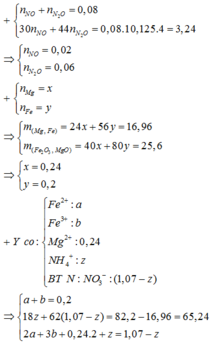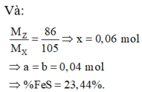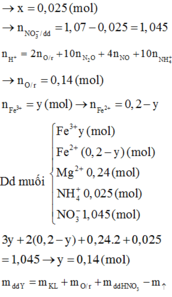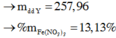Đốt cháy hết 27,6 hỗn hợp X gồm FeS2 và Cú trong bình chứa khí oxi dư thu được chất rắn Y có khối lượng giảm 7,6g tính%khối lượng mỗi chất trong X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Z gồm CO2 và O2 dư
$C + O_2 \xrightarrow{t^o} CO_2$
$n_{CO_2} =n_{O_2\ pư} = n_C = \dfrac{1,128}{12} = 0,094(mol)$
Gọi $n_{O_2} = 2a \to n_{không\ khí} = 3a(mol)$
Trong Y :
$n_{O_2} = 2a + 3a.20\% = 2,6a(mol)$
$n_{N_2} = 3a.80\% = 2,4a(mol)$
Trong Z :
$n_{CO_2} = 0,094(mol)$
$n_{N_2} = 2,4a(mol)$
$n_{O_2\ dư} = n_{O_2} - n_{O_2\ pư} = 2,6a - 0,094(mol)$
m CO2 =0,094.44 = 4,136(gam)
=> m Z = 4,136 : 27,5% = 15,04(gam)
SUy ra :
4,136 + 2,4a.28 + (2,6a - 0,094).32 = 15,04
=> a = 0,0925
=> n O2 = 0,0925.2 = 0,185(mol)
m X = 43,5 : 46,4% = 93,75(gam)
Bảo toàn khối lượng : m = 93,75 + 0,185.32 = 99,67(gam)

Đáp án B
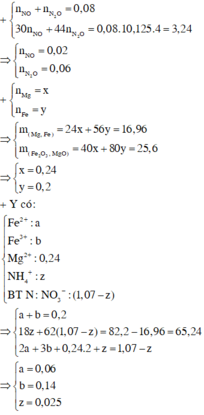
n o trong Z = 0 , 17 C % Fe NO 3 3 = 0 , 14 . 242 16 , 96 + 0 , 17 . 2 + 242 - 3 , 24 . 100 ≈ 13 %

a, Ta có: \(n_{Al}=\dfrac{13,5}{27}=0,5\left(mol\right)\)
\(n_{O_2}=\dfrac{7,437}{24,79}=0,3\left(mol\right)\)
PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Xét tỉ lệ: \(\dfrac{0,5}{4}>\dfrac{0,3}{3}\), ta được Al dư.
Theo PT: \(\left\{{}\begin{matrix}n_{Al_2O_3}=\dfrac{2}{3}n_{O_2}=0,2\left(mol\right)\\n_{Al\left(pư\right)}=\dfrac{4}{3}n_{O_2}=0,4\left(mol\right)\end{matrix}\right.\)
⇒ nAl (dư) = 0,5 - 0,4 = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al_2O_3}=0,2.102=20,4\left(g\right)\\m_{Al\left(dư\right)}=0,1.27=2,7\left(g\right)\end{matrix}\right.\)
b, \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2}=\dfrac{0,015.0,082.\left(25+273\right)}{0,986}\approx3,7274\left(l\right)\)

a, PT: \(4FeS+7O_2\underrightarrow{t^o}2Fe_2O_3+4SO_2\)
\(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
Giả sử: \(\left\{{}\begin{matrix}n_{FeS}=x\left(mol\right)\\n_{FeS_2}=y\left(mol\right)\end{matrix}\right.\)
⇒ 88x + 120y = 17,8 (1)
Ta có: \(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_{SO_2}=n_{FeS}+2n_{FeS_2}=x+2y\left(mol\right)\)
⇒ x + 2y = 0,25 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,075\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeS}=0,1.88=8,8\left(g\right)\\m_{FeS_2}=0,075.120=9\left(g\right)\end{matrix}\right.\)
b, Theo PT: \(n_{O_2}=\dfrac{7}{4}n_{FeS}+\dfrac{11}{4}n_{O_2}=0,38125\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,38125.22,4=8,54\left(l\right)\)
Bạn tham khảo nhé!
a) Gọi nFeS = a (mol)
\(n_{FeS_2}=b\left(mol\right)\) với a; b > 0
\(n_{SO_2}=\dfrac{V}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}m_{hh}=17,8=m_{FeS}+m_{FeS_2}=88a+120b\\n_{S\left(SO_2\right)}=0,25=n_{FeS}+2n_{FeS_2}\left(bt\left[S\right]\right)=a+2b\end{matrix}\right.\)
=> a = 0,1(mol); b = 0,075(mol)
mFeS= n.M= 0,1 . 88 = 8,8(g)
=> \(m_{FeS_2}=m_{hh}-m_{FeS}=17,8-8,8=9\left(g\right)\)
b) PT:
\(4FeS+7O_2\underrightarrow{t^o}2Fe_2O_3+4SO_2\uparrow\\ 4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\uparrow\)
\(Theo2pt\Rightarrow n_{O_2}=\dfrac{7n_{FeS}+11n_{FeS_2}}{4}=0,38125\left(mol\right)\)
\(\Rightarrow V_{O_2}=n\cdot22,4=0,38125\cdot22,4=8,54\left(l\right)\)

Gọi số mol C, S là a, b
=> 12a + 32b = 7,68
PTHH: C + O2 --to--> CO2
_____a--------------->a
S + O2 --to--> SO2
b--------------->b
=> a + b = \(\dfrac{9,856}{22,4}=0,44\)
=> a = 0,32; b = 0,12
=> \(\left\{{}\begin{matrix}\%C=\dfrac{0,32.12}{7,68}.100\%=50\%\\\%S=\dfrac{0,12.32}{7,68}.100\%=50\%\end{matrix}\right.\)

PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\) (1)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\) (2)
\(C+O_2\underrightarrow{t^o}CO_2\) (3)
Ta có: \(n_{KCl}=\dfrac{1,49}{74,5}=0,02\left(mol\right)\)
\(n_C=\dfrac{0,24}{12}=0,02\left(mol\right)\)
\(m_Y=\dfrac{1,49}{17,028\%}=8,75\left(g\right)\), Y gồm: KCl, KMnO4 (dư), K2MnO4, MnO2.
Theo PT (3): \(n_{CO_2}=n_{O_2\left(pư\right)}=n_C=0,02\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=\dfrac{0,02}{40\%}-0,02=0,03\left(mol\right)\)
⇒ ΣnO2 = 0,02 + 0,03 = 0,05 (mol)
Theo PT (1): \(n_{O_2\left(1\right)}=\dfrac{3}{2}n_{KCl}=0,03\left(mol\right)\)
\(\Rightarrow n_{O_2\left(2\right)}=0,05-n_{O_2\left(1\right)}=0,02\left(mol\right)\)
Theo PT (2): \(n_{K_2MnO_4}=n_{MnO_2}=n_{O_2\left(2\right)}=0,02\left(mol\right)\)
\(n_{KMnO_4\left(pư\right)}=2n_{O_2}=0,04\left(mol\right)\)
Mà: mKCl + mKMnO4 (dư) + mK2MnO4 + mMnO2 = 8,75
⇒ mKMnO4 (dư) = 1,58 (g) \(\Rightarrow n_{KMnO_4\left(dư\right)}=\dfrac{1,58}{158}=0,01\left(mol\right)\)
\(\Rightarrow H\%=\dfrac{0,04}{0,04+0,01}.100\%=80\%\)