Cho a gam FeO tác dụng với dung dịch H2SO4 thu được 200ml dung dịch FeSO4 1M.Tính a?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{FeSO_4}=\dfrac{200}{1000}.1=0,2\left(mol\right)\)
\(PTHH:FeO+H_2SO_4--->FeSO_4+H_2O\)
Theo PT: \(n_{FeO}=n_{FeSO_4}=0,2\left(mol\right)\)
\(\Rightarrow a=m_{FeO}=0,2.72=14,4\left(g\right)\)
\(n_{FeSO_4}=1\cdot0,2=0,2\left(mol\right)\\ PTHH:FeO+H_2SO_4\rightarrow FeSO_4+H_2O\\ \Rightarrow n_{FeO}=n_{FeSO_4}=0,2\left(mol\right)\\ \Rightarrow a=m_{FeO}=0,2\cdot72=14,4\left(g\right)\)

\(n_{FeO}=\dfrac{14,4}{72}=0,2\left(mol\right)\)
PTHH : \(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
Theo Pt : \(n_{FeO}=n_{H2SO4}=n_{FeSO4}=0,2\left(mol\right)\)
\(m_{ddH2SO4}=\dfrac{0,2.98}{9,8\%}.100\%=200\left(g\right)\)
\(m_{ddspu_{ }}=14,4+200=214,4\left(g\right)\)
\(C\%_{FeSO4}=\dfrac{0,2.152}{214,4}.100\%=14,18\%\)

a,\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,1 0,1 0,1 0,1
b,\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c,\(C_{M_{ddH_2SO_4}}=\dfrac{0,1}{0,2}=0,5M\)
d,\(C_{M_{ddFeSO_4}}=\dfrac{0,1}{0,2}=0,5M\)

Đáp án B
Dùng phương pháp đường chéo tính được mol CO2 là 0,2 mol và H2 là 0,15 mol.
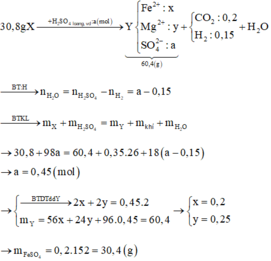

Đáp án C
Sơ đồ phản ứng:
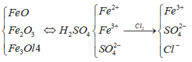
Khối lượng muối tăng là do có thêm lượng Cl-.
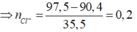
Ta thấy, Fe2+ phản ứng với Cl2.
![]()
Trong 90,4 gam muối khan có FeSO4 và Fe2(SO4)3.
Ta có:
![]()
Quy đổi hỗn hợp đầu về FeO và Fe2O3.
Khối lượng hỗn hợp là: m = 0,2×72 + 0,15×160 = 38,4


\(n_{FeSO_4}=0,2.1=0,2\left(mol\right)\)
PTHH: FeO + H2SO4 → FeSO4 + H2O
Mol: 0,2 0,2
\(m_{FeO}=0,2.72=14,4\left(g\right)\)