Hào tan 3,6 gam kim loại M (chỉ có một hóa trị duy nhất trong hợp chất) vào 200ml dung dịch hỗn hợp HCl 1,25M và H2SO4 1,5M. Dung dịch thu được sau phản ứng làm đỏ quỳ tím và phải trung hòa bằng 100ml dung dịch hỗn hợp NaOH 2,5M và Ba(OH)2 1,5M. Xác định kim loại M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Thí nghiệm 2 : n HCl = 18,25/36,5 = 0,5(mol)
$M + 2HCl \to MCl_2 + H_2$
Vì HCl dư nên : 2n M < 0,5
<=> n M < 0,25
<=> M > 4,6/0,25 = 18,4 (1)
Thí nghiệm 1: n H2 = 4,48/22,4 = 0,2(mol)
n M = a(mol)
$Fe + 2HCl \to FeCl_2 + H_2$
=> n Fe = 0,2 - a(mol)
Ta có : 0 < a < 0,2
M,a + 56.(0,2 - a) = 9,6
<=> M = (56a - 1,6)/a
<=> M < 48 (2)
Từ (1)(2) suy ra 18,4 < M < 48
- Nếu M = 40(Ca)
Ta có : 40a + 56(0,2 -a) = 9,6 => a = 0,1
m Ca = 0,1.40 = 4(gam)
m Fe = 9,6 -4 = 5,6(gam)
- Nếu M = 24(Mg)
Ta có : 24a + 56(0,2 -a) = 9,6 => a = 0,05
m Mg = 0,05.24 = 1,2(gam)
m Fe = 9,6 -1,2 = 8,4(gam)

Đáp án B
n H 2 SO 4 = 100 . 0 , 392 98 = 0 , 4 mol
Sau phản ứng thu được dung dịch Y chỉ chứa một chất tan Þ phản ứng vừa đủ, H2SO4 phản ứng hết
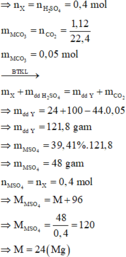

Đáp án : C
nH2SO4 = 0,4 mol
Vì sau phản ứng có 1 chất tan duy nhất => đó chính là MSO4 => nMSO4 = nH2SO4 = 0,4 mol
Bảo toàn khối lượng : mX + mdd H2SO4 = mY + mCO2
=> mY = 121,8g => mMSO4 =48g
=> MMSO4 = M + 96 = 120 => M = 24 (Mg)

Đáp án C.
MY = 18,8 Y chứa NO (3y) và H2 (2y) X chứa H+ và NO3- dư.
nNO = 0,26 mol
Bảo toàn khối lượng:
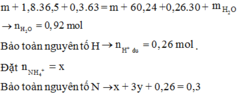
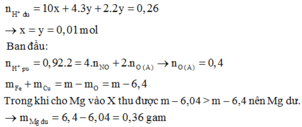
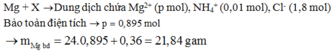
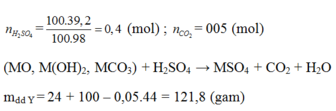
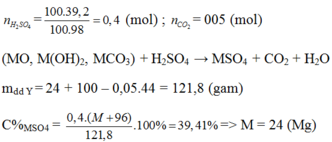

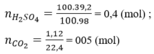

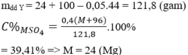
Cho hỏi 200 ml HCl ; 200 ml H2SO4 hay sao v; :3 nếu ko phải như thế này mk bí
200 ml cả hai nhé
Nhưng mà tính số mol hai cái đó cx đc mà
K đc xài ion+ j j đó đâu nha