Câu 1 : Trong tự nhiên , Sb có 2 đồng vị , biết đồng vị 12151Sb chiếm 62% có A trung bình = 121,76.Xác định nguyên tử khối và viết kí hiệu ccủa đồng vị thứ 2
Câu 2 : Mg có 2 đồng vị ; 2412Mg chiếm 80% ; AMg= 24,2. Hãy viết kí hiệu , cấu hình e của đồng vị thứ 2

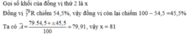
Câu 1:
Đặt đồng vị thứ hai là: \(^a_{51}Sb\)
\(\Rightarrow\%_{^aSb}=100\%-62\%=38\%\)
Mà \(\overline{A}=121,76\)
\(\Leftrightarrow\dfrac{121.62+a.38}{100}=121,76\)
\(\Rightarrow a=123\)
Vậy nguyên tử khối của đồng vị thứ hai mà 123
Kí hiệu: \(^{123}_{51}Sb\)
câu 2: phần trăm của đồng vị thứ 2 = 100% - 80%=20%. Gọi x là đồng vị thứ 2
AMg = 24*80+x*20/100
24,2=24*80+x*20/100
suy ra 2420=1920+20x
vậy x=25