Trộn lẫn 3dd HCL 0,05M; H2SO4 0,02M và HNO3 0,06M theo tỉ lệ tương ứng là 1 : 2 : 2 thu được dd có pH là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ví dụ 5 :
n KOH = 0,02.0,35 = 0,007(mol)
n HCl = 0,08.0,1 = 0,008(mol)
$KOH + HCl \to KCl + H_2O$
n HCl pư = n KOH = 0,007(mol)
=> n HCl dư = 0,008 - 0,007 = 0,001(mol)
V dd = 0,02 + 0,08 = 0,1(mol)
=> [H+ ] = CM HCl dư = 0,001/0,1 = 0,01M
=> pH = -log(0,01) = 2

\(n_{KOH}=0,2.0,3=0,06mol\)
\(n_{H_2SO_4}=0,2.0,05=0,01mol\)
2KOH+H2SO4\(\rightarrow\)K2SO4+2H2O
\(\dfrac{0,06}{2}=0,03>\dfrac{0,01}{1}=0,01\)
KOH dư, H2SO4 hết
\(n_{KOH}\left(pu\right)=2n_{H_2SO_4}=0,02mol\)
\(n_{KOH\left(dư\right)}=0,06-0,02=0,04mol\)
Vdd=200+200=400ml=0,4 lít
\(C_{M_{KOH}}=\dfrac{n}{v}=\dfrac{0,04}{0,4}=0,1M\)
pH=14+lg[OH-]=14+lg0,1=13

1) \(n_{H^+}=n_{HCl}+2n_{H2SO4}\)
= 0,0025 + 2.0,0025
= 0,0075(mol)
\(\Rightarrow\left[H^+\right]_{sau.khi.trộn}=\dfrac{0,0075}{0,1+0,05}=0,05M\)
\(\Rightarrow pH=-log\left(0,05\right)\approx1,3\)
Chúc bạn học tốt
2) \(n_{HCl}=0,5.0,04=0,02\left(mol\right)\)
\(n_{NaOH}=0,5.0,06=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,02 0,03
Xét tỉ lệ : \(0,02< 0,03\Rightarrow OH^-dư\)
\(n_{OH^-\left(dư\right)}=0,03-0,02=0,01\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,01}{0,04+0,06}=0,1M\)
\(\Rightarrow pH=14+log\left(0,1\right)=13\)
Chúc bạn học tốt

nH2SO4 = 0,02 mol; nHCl = 0,02 mol → ∑ nH + = 0,02.2 + 0,02 = 0,06 mol
→ [H+] = n V = 0 , 06 0 , 1 + 0 , 4 = 0,12 → pH = –lg[H+] = –lg0,12 = 0,92
Đáp án C
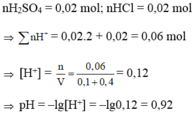
Đặt \(n_{HCl}=a\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=a\left(mol\right)\\n_{H_2SO_4}=2a\left(mol\right)\\n_{HNO_3}=2a\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}V_{ddHCl}=\dfrac{a}{0,05}\left(l\right)\\V_{ddH_2SO_4}=\dfrac{2a}{0,02}=\dfrac{a}{0,01}\left(l\right)\\V_{ddHNO_3}=\dfrac{2a}{0,06}=\dfrac{a}{0,03}\left(l\right)\end{matrix}\right.\)
\(\Rightarrow n_{H^+}=7a\left(mol\right);V_{dd}=\dfrac{a}{0,05}+\dfrac{a}{0,01}+\dfrac{a}{0,03}=\dfrac{460a}{3}\left(l\right)\)
\(\Rightarrow pH=-log\left(\dfrac{7a}{\dfrac{460a}{3}}\right)=1,34\)