Hòa tan hỗn hợp A gồm nhôm và nhôm oxit có tỉ lệ về khối lượng là 3 : 17 trong dung dịch natri hidroxit vừa đủ thu được dung dịch B và 0,672 lít hidro. Cho B tác dụng với 200 ml dung dịch axit clohidric nồng độ aM thu được kết tủa D. Nung D đến khối lượng không đổi thu được 3,575 gam chất rắn. Tính a
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nH2 = 0,03 ⇒ nAl = 0,02 ⇒ mAl = 0,54g
⇒ mAl2O3 = ⇒ nAl2O3 bđ = 0,03
Bảo toàn nguyên tố Al ⇒ nNaAlO2 = nAl + 2nAl2O3 bđ = 0,08
nAl2O3 thu được = 3,57/102 = 0,035 ⇒ nAl(OH)3 = 0,07
Trường hợp 1: NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
⇒ HCl = nAl(OH)3 = 0,07 [HCl] = 0,07/0,2 = 0,35M
Trường hợp 2:
NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
0,07 ← 0,07 ← 0,07
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
(0,08 – 0,07) → 0,04
⇒ nHCl = 0,11 ⇒ [HCl] = 0,11/0,2 = 0,55M
Vậy chọn D.

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
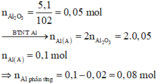
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
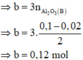
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
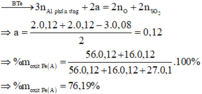

Đáp án D
Ta có n O 2 = 0,05 mol; nNaOH = 0,2. 2 = 0,4 mol
Đặt nCO = x mol; nNO = y mol
→ M X ¯ = m h h n h h = 28 x + 30 y x + y = 14 , 5 . 2 = 29
→x - y = 0 (1)
2CO + O2 → 2CO2
2NO+ O2 →2 NO2
Theo 2 PTHH trên ta có:
n O 2 = 0,5. (nCO + nNO) = 0,5.(x+y) = 0,05 mol (2)
Từ (1) và (2) ta có x = y = 0,05 mol
→Hỗn hợp khí Y có 0,05 mol CO2 và 0,05 mol NO2
Cho Y vào dung dịch NaOH ta có:
CO2+ 2NaOH → Na2CO3+ H2O
0,05 → 0,1
2NO2+ 2NaOH → NaNO2+ NaNO3+ H2O
0,05 0,05
Tổng số mol NaOH phản ứng là 0,1+ 0,05 = 0,15 mol → nNaOH dư = 0,25 mol
Vậy trong dung dịch mới có chứa Na2CO3, NaNO2, NaNO3, NaOH (4 chất tan)

\(a)n_{H_2}=\dfrac{5,6}{22,4}=0,25mol\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{1}{6}\) \(0,5\) \(\dfrac{1}{6}\) \(0,25\)
\(\%m_{Al}=\dfrac{1:6.27}{25}\cdot100=18\%\\ \%m_{Al_2O_3}=100-18=82\%\\ b)n_{Al_2O_3}=\dfrac{25-1:6.27}{102}=\dfrac{41}{204}mol\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(\dfrac{41}{204}\) \(\dfrac{41}{36}\) \(\dfrac{41}{102}\)
\(m_{ddHCl}=\dfrac{\left(0,5+41:36\right)36,5}{20}\cdot100=299,1g\\ V_{ddHCl}=\dfrac{299,1}{1,1}=271,9ml\)
\(m_{dd}=299,1+25-0,25.2=323,6g\)
\(m_{AlCl_3}=\left(\dfrac{1}{6}+\dfrac{41}{102}\right)\cdot133,5=75,9g\\ C_{\%AlCl_3}=\dfrac{75,9}{323,6}\cdot100=23,45\%\)

a)
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$MgO + 2HCl \to MgCl_2 + H_2O$
Theo PTHH : $n_{Al} = \dfrac{2}{3}n_{H_2} = 0,2(mol)$
$\%m_{Al} = \dfrac{0,2.27}{18,8}.100\% = 28,7\%$
$\%m_{MgO} = 100\% - 28,7\% =71,3\%$
b) $n_{MgO} = 0,335(mol)$
Theo PTHH : $n_{HCl} = 2n_{H_2} + 2n_{MgO} =1,27(mol)$
$V_{dd\ HCl} = \dfrac{1,27}{1,6} = 0,79375(lít)$
c)
$H_2 + O_{oxit} \to H_2O$
$\Rightarrow n_{O(oxit)} = n_{H_2} = 0,3(mol)$
$\Rightarrow n_{Fe} = \dfrac{17,4 - 0,3.16}{56} = 0,225(mol)$
Ta có :
$n_{Fe} : n_O = 0,225 : 0,3 = 3 : 4$
Vậy oxit là $Fe_3O_4$

