Cho m(g) Mg tác dụng vừa đủ 400g dung dịch HCl 3,65 a) Viết PTHH xảy ra và tính thể tích H2 thu được ở Đktc b) Tính khối lượng Mg tác dụng c) Tính khối lượng dung dịch MgO2 sau phản ứng và C% dd Mgcl2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a. PTHH : Mg + 2HCl ➝ MgCl2 + H2 (1)
b. theo bài : nH2 = 3,36 : 22,4 = 0,15 (mol)
theo (1) nMg = nH2 = 0,15 (mol)
➞ mMg = 0,15 ✖ 24 = 3,6 (g)
➞ %mMg = (3,6 : 5)✖100 = 72%
➞ %mCu = 100% - 72% = 28%
c. theo (1) nHCl = 2nH2 = 2✖0,15 = 0,3 (mol)
mHCl = 0,3✖36,5 = 10,95(g)
➜mddHCl = (10,95✖100):14,6 = 75(g)
d. dung dịch Y : MgCl2
mdd(spư)= 3,6+75-0,3 = 78,3(g)
theo (1) nMgCl2 = nH2 = 0,15(mol)
mMgCl2 = 0,15✖95 = 14,25(g)
C%MgCl2 = (14,25 : 78,3)✖100 = 18,199%

\(a,PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\\b,n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\Rightarrow n_{MgCl_2}=n_{H_2}=n_{Mg}=0,1\left(mol\right);n_{HCl}=2.0,1=0,2\left(mol\right)\\ b,m_{ddHCl}=\dfrac{0,2.36,5.100}{20}=36,5\left(g\right)\\ c,m_{ddsau}=2,4+36,5-0,1.2=38,7\left(g\right)\\ C\%_{ddMgCl_2}=\dfrac{0,1.95}{38,7}.100\approx24,548\%\)

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b, \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Mg}=0,2\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{0,2.36,5}{20\%}=36,5\left(g\right)\)
c, \(n_{MgCl_2}=n_{H_2}=n_{Mg}=0,1\left(mol\right)\)
Ta có: m dd sau pư = 2,4 + 36,5 - 0,1.2 = 38,7 (g)
\(\Rightarrow C\%_{MgCl_2}=\dfrac{0,1.95}{38,7}.100\%\approx24,55\%\)

\(n_{HCl}=\dfrac{18.25}{36.5}=0.5\left(mol\right)\)
\(a.Mg+2HCl\rightarrow MgCl_2+H_2\)
\(b.\)
\(n_{Mg}=n_{H_2}=\dfrac{1}{2}\cdot n_{HCl}=\dfrac{1}{2}\cdot0.5=0.25\left(mol\right)\)
\(m_{Mg}=0.25\cdot24=6\left(g\right)\)
\(V_{H_2}=0.25\cdot22.4=5.6\left(l\right)\)
\(c.\)
\(V_{H_2\left(tt\right)}=5.6\cdot90\%=5.04\left(l\right)\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 0,1
\(m_{HCl}=0,2.36,5=7,3\left(g\right)\\
V_{H_2}=0,1.22,4=2,24l\\
m_{\text{dd}}=6,5+200-\left(0,1.2\right)=206,3g\)
bài 2 :
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\
pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(m_{HCl}=0,4.36,5=14,6g\\
V_{H_2}=0,2.22,4=4,48l\\
m\text{dd}=4,8+200-0,4=204,4g\\
C\%=\dfrac{0,2.136}{204,4}.100\%=13,3\%\)

Câu 1
\(a)PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\\
b)200ml=0,2l\\
n_{HCl}=0,2.1=0,2mol\\
n_{H_2}=n_{MgCl_2}=\dfrac{1}{2}n_{H_2}=\dfrac{1}{2}\cdot0,2=0,1mol\\
V_{H_2}=0,1.24,79=2,479l\\
c)C_{M_{MgCl_2}}=\dfrac{0,1}{0,2}=0,5M\)

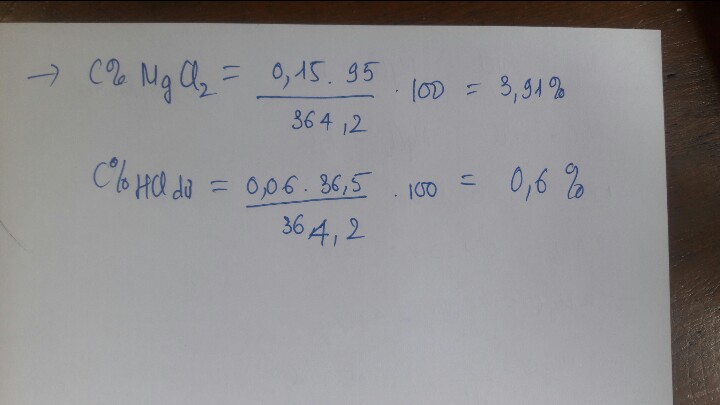
mHCl= 3,65%.400= 14,6(g) => nHCl=14,6/36,5=0,4(mol)
a) PTHH: Mg +2 HCl -> MgCl2 + H2
0,2__________0,4_____0,2____0,2(mol)
V(H2,đktc)=0,2.22,4=4,48(l)
b)mMg=0,2.24=4,8(g)
c) mMgCl2= 0,2.95=19(g)
mddMgCl2= 400+4,8 - 0,2.2= 404,4(g)
=> C%ddMgCl2= (19/404,4).100=4,698%