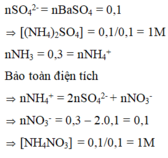cho dung dịch Ba(OH)2 đến dư vào 100 ml dung dịch X gồm các ion : NH4+ , SO42- , NO3- rồi tiến hành đun nóng thì thu được 23,3 gam kết tủa và 6,72 lít ( điều kiện tiêu chuẩn ) một chất khí duy nhất . nồng độ mol của (NH4)2SO4 và NH4NO3 trong dung dịch X là bao nhiêu ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn D
nSO42- = nBaSO4 = 0,1 ⇒ [(NH4)2SO4] = 0,1/0,1 = 1M
nNH3 = 0,3 = nNH4+
Bảo toàn điện tích ⇒ nNH4+ = 2nSO42- + nNO3- ⇒ nNO3- = 0,3 – 2.0,1 = 0,1
⇒ [NH4NO3] = 0,1/0,1 = 1M

Đáp án B
Ba2++ SO42- →BaSO4
0,1 ← 23,3/233
NH4++ OH- →NH3+ H2O
0,3← 0,3
Theo ĐLBT ĐT thì: nNO3(-)=0,1 mol
Vậy dung dịch X có 0,1 mol (NH4)2SO4 và 0,1 mol NH4NO3
Suy ra nồng độ mol (NH4)2SO4 1M và NH4NO3 1M

nBaSO4 = 0,1 ; nNH3 = 0,3
Ba2+ + SO42- → BaSO4
0,1 ← 0,1 (mol)
NH4+ + OH- → NH3 + H2O
0,3 0,3 (mol)
Bảo toàn ion có nNO3- = 0,1
⇒ n(NH4)2SO4 = 0,1 ; nNH4NO3 = 0,1
⇒ Nồng độ mol/lít của (NH4)2SO4 và NH4NO3 lần lượt là 1M và 1M
Đáp án B.