cho 9 gam hỗn hợp gồm Al và Mg tác dụng với dung dịch HNO3 đặc nóng dư thu được 10,08 lít khí ở 0oC , 2 atm . thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp đầu là bao nhiêu ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nNO2 =\(\frac{PV}{RT}\)=0,9
\(\begin{cases}27x+24y=9\\3x+2y=0,9\end{cases}\)(1 phương trình về khối lượng và 1 phương trình về bảo toàn e)
<=>\(\begin{cases}x=0,2\\y=0,15\end{cases}\)
=>%mAl =((0,2*27)/9)*100=60%
=>%mMg =40%

Đáp án : A
P1 : ne trao đổi = nNO2 = 0,47 mol
P2 : ne trao đổi = nCl2 .2 => nCl2 pứ = 0,235 mol
=> mKL = mmuối – mCl2 pứ = 11,19g
=> m = 2.11,19 = 22,38g

QT cho e: Xét với ½ khối lượng hỗn hợp
Mg→ Mg2++ 2e (1)
x 2x mol
Al→ Al3++ 3e (2)
y 3y mol
Cu→ Cu2++ 2e (3)
z 2z mol
→ne cho= 2x+ 3y+2z mol
QT nhận e:
-Phần 1: nNO2=0,47 mol
N+5+ 1e→ NO2
0,47 0,47 mol
Theo ĐL bảo toàn e: ne cho= 2x+ 3y+2z = ne nhận= 0,47
-Phần 2:
Cl2+ 2e→ 2Cl-
0,47 0,47
Theo ĐL bảo toàn e: ne cho= 2x+ 3y+2z = ne nhận= 0,47
mmuối clorua= mkim loại+ mCl-= mkim loại+ 0,47.35,5=27,875 → mkim loại=11,19 gam → m= 11,19.2=22,38 gam

a)
$Cu + 4HNO_3 \to Cu(NO_3)_2 + 2NO_2 + 2H_2O$
$Ag + 2HNO_3 \to AgNO_3 + NO_2 + H_2O$
b)
Gọi $n_{Cu} = a(mol) ; n_{Ag} = b(mol) \Rightarrow 64a + 108b = 4,52(1)$
$n_{NO_2} =2a + b = 0,07(2)$
Từ (1)(2) suy ra a = 0,02 ; b = 0,03
$\%m_{Cu} = \dfrac{0,02.64}{4,52}.100\% = 28,31\%$
$\%m_{Ag} = 71,69\%$

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
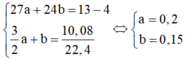
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.