Cho 104 gam BaCl2 vào 200 gam dung dịch H2 SO4 Lọc bỏ kết tủa trung hòa dung dịch nước lọc cần dùng 250ml dung dịch NaOH 25% (D=1.28g/ml) tính nồng độ phần trăm của H2 SO4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1) \(n_{Al\left(OH\right)_3}=\dfrac{0,78}{78}=0,01\left(mol\right)\)
PTHH: \(Al_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,03<----------------------0,01
=> nNaOH min = 0,03 (mol)
=> \(C_{M\left(NaOH\right)}=\dfrac{0,03}{0,2}=0,15M\)
2) \(n_{Al_2O_3}=\dfrac{5,1}{102}=0,05\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=0,3.0,25=0,075\left(mol\right)\)
PTHH: \(6NaOH+Al_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,45<------0,075-------------------------->0,15
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
0,05<----0,05
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
0,1<-------0,05
=> nNaOH max = 0,5 (mol)
=> \(V_{dd}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)
3)
\(n_{KOH\left(1\right)}=0,15.1,2=0,18\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(1\right)}=\dfrac{4,68}{78}=0,06\left(mol\right)\)
\(n_{AlCl_3}=0,1.x\left(mol\right)\)
Do khi cho KOH tác dụng với dd Y xuất hiện kết tủa
=> Trong Y chứa AlCl3 dư
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
0,18---->0,06----------------->0,06
\(n_{KOH\left(2\right)}=0,175.1,2=0,21\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(2\right)}=\dfrac{2,34}{78}=0,03\left(mol\right)\)
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
(0,3x-0,18)<--(0,1x-0,06)------->(0,1x-0,06)
\(KOH+Al\left(OH\right)_3\rightarrow KAlO_2+2H_2O\)
(0,1x-0,09)<-(0,1x-0,09)
=> \(\left(0,3x-0,18\right)+\left(0,1x-0,09\right)=0,21\)
=> x = 1,2

Em ko có tiền nên mong a , cj tham khảo(đây là 500 g dung dịch nên mong a, cj sửa 1 chút ạ)
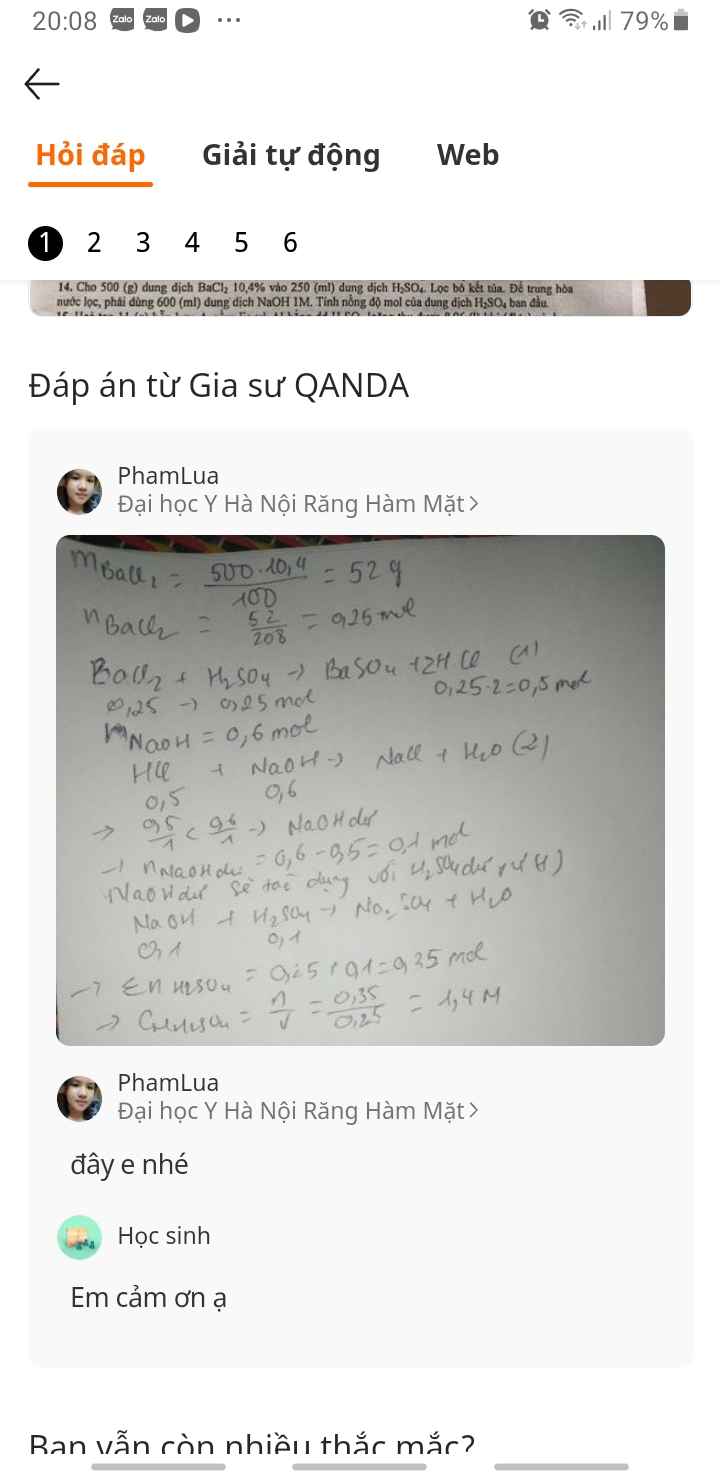

a)
$BaCl_2 + H_2SO_4 \to BaSO_4 + 2HCl$
$n_{BaCl_2} = 0,1 < n_{H_2SO_4} = 0,2$ nên $H_2SO_4$ dư
$n_{BaSO_4} = n_{BaCl_2} = 0,1(mol)$
$m_{BaSO_4} = 0,1.233 = 23,3(gam)$
b)
A gồm :
$HCl : 0,1.2 = 0,2(mol)$
$H_2SO_4\ dư : 0,2 - 0,1 = 0,1(mol)$
$V_{dd} = 0,1 + 0,1= 0,2(lít)$
$C_{M_{HCl}} = \dfrac{0,2}{0,2} = 1M$
$C_{M_{H_2SO_4}} = \dfrac{0,1}{0,2} = 0,5M$
c)
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
$n_{NaOH} = 2n_{H_2SO_4\ dư} = 0,2(mol)$
$m_{dd\ NaOH} = \dfrac{0,2.40}{15\%} = 53,33(gam)$

\(m_{ct}=\dfrac{19,6.200}{100}=39,2\left(g\right)\)
\(n_{H2SO4}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
\(m_{ct}=\dfrac{5,2.200}{100}=10,4\left(g\right)\)
\(n_{BaCl2}=\dfrac{10,4}{208}=0,05\left(mol\right)\)
Pt : \(H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4|\)
1 1 2 1
0,4 0,05 0,1 0,05
a) Lập tỉ số so sánh: \(\dfrac{0,4}{1}>\dfrac{0,05}{1}\)
⇒ H2SO4 dư , BaCl2 phản ứng hết
⇒ Tính toán dựa vào số mol của BaCl2
\(n_{BaSO4}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
⇒ \(m_{BaSO4}=0,05.233=11,65\left(g\right)\)
b) \(n_{HCl}=\dfrac{0,05.2}{1}=0,1\left(mol\right)\)
⇒ \(m_{HCl}=0,1.36,5=3,65\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,4-0,05=0,35\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,35.98=34,3\left(g\right)\)
\(m_{ddspu}=200+200-11,65=388,35\left(g\right)\)
\(C_{ddHCl}=\dfrac{3,65.100}{388,35}=0,94\)0/0
\(C_{ddH2SO4\left(dư\right)}=\dfrac{34,3.100}{388,35}=8,83\)0/0
Chúc bạn học tốt
\(a.n_{H_2SO_4}=\dfrac{200.19,6\%}{98}=0,4\left(mol\right)\\ n_{BaCl_2}=\dfrac{200.5,2\%}{208}=0,05\left(mol\right)\\ BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\\ Vì:\dfrac{0,05}{1}< \dfrac{0,4}{1}\\ \Rightarrow H_2SO_4dư\\ n_{BaSO_4}=n_{BaCl_2}=0,05\left(mol\right)\\ \Rightarrow m_{\downarrow}=m_{BaSO_4}=0,05.233=11,65\left(g\right)\\ b.m_{ddsau}=200+200-11,65=388,35\left(g\right)\\ C\%_{ddHCl}=\dfrac{0,05.2.36,5}{388,35}.100\approx0,94\%\\ C\%_{ddH_2SO_4\left(dư\right)}=\dfrac{\left(0,4-0,05\right).98}{388,35}.100\approx8,832\%\)
Khối lượng dd NaOH : 1,28*250= 80g => nNaOH = (80*25/100)/40 = 2mol
PT : BaCl2 + H2SO4 ----> BaSO4 + 2HCl
0,05mol --> 0,05mol
H2SO4 + 2NaOH -------> Na2SO4 + 2H2O
1mol <--- 2mol
hoep t trên ta có tổng số mol của H2SO4 : 0,05+1 = 1,05mol => mH2SO4 = 98*1,05 =102,9g
Vậy c%H2SO4 : 102,9/200*100= 51,45%
khối lượng BaCl2 * với 10 ở đâu ra vậy bạn