Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi n là hóa trị của M
\(M\rightarrow M^{2+}+ne\\ N^{5+}+3e\rightarrow N^{2+}\\ BTe:n_M.n=n_{NO}.3\\ \Rightarrow\dfrac{19,2}{M}.n=0,2.3=0,6\\ \Rightarrow M=32n\\ Chạynghiệm\Rightarrow n=2,M=64\left(tm\right)\)
=> Chọn B

Sửa đề : khí NO
\(n_{NO}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(\text{Bảo toàn e : }\)
\(n_M=\dfrac{3n_{NO}}{n}=\dfrac{0.6}{n}\left(mol\right)\)
\(M_M=\dfrac{19.2}{\dfrac{0.6}{n}}=32n\left(\dfrac{g}{mol}\right)\)
\(BL:n=2\Rightarrow M=64\)
\(Mlà:Cu\)
Ta có: nNO2=\(\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
PTHH: \(3M+4HNO_3->3M\left(NO_3\right)_n+nNO+2H_2O\)
Dựa vào pthh tính đưuọc nM=\(\dfrac{0.6}{n}\)
Ta có: \(M_M=\dfrac{19.2}{\dfrac{0.6}{n}}=32n\)
Vì M là kim loại nên n có thể = 1,2,3
Tìm n=2 là hợp lý nhất=> n=2 thì M=64. Vậy M là Cu

Đáp án B
n H 2 = 0 , 1 ; n NO = 0 , 4 . Gọi n là hóa trị của M.
Căn cứ vào 4 đáp án ta có 2 trường hợp:
+) M là kim loại đứng trước H trong dãy hoạt động hóa học. Khi đó cả M và Fe có phản ứng với dung dịch HCl. Vì hóa trị của M không đổi nên sự chênh lệch về số electron trao đổi trong hai lần thí nghiệm là do sắt có hai mức hóa trị là II và III.
Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có: 2 n Fe + n . n M = 2 n H 2
- Khi hòa tan hỗn hợp vào dung dịch HNO3, ta có: 3 n Fe + n . n M = 3 n NO
Trừ hai vế của hai phương trình cho nhau, ta được:
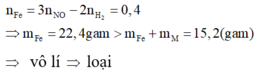
+) M là kim loại đứng sau H và trước Pt trong dãy hoạt động hóa học. Khi đó M không phản ứng được với dung dịch HCl và phản ứng được với dung dịch HNO3. Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có:


Đáp án A
Do Fe dư nên chỉ tạo ra Fe2+.
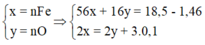
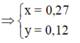
4H+ + NO3- + 3e → NO + 2H2O
2H+ + O + 2e → H2O
=> nHNO3 = nH+ = 4nNO + 2nO = 4.0,1 + 2.0,12 = 0,64
=> [HNO3] = 0,64/0,2 = 3,2M => Chọn A.

Phần 1: tác dụng với HNO3 đặc, nguội ⇒ Fe không phản ứng, sản phẩm khử của N + 5 là NO2 (do dùng HNO3 đặc).
⇒ Bảo toàn electron có: 2nCu = n NO 2 = 0,03 mol
⇒ nCu = 0,015 mol.
Phần 2: tác dụng với H2SO4 loãng ⇒ Cu không phản ứng, chỉ có Fe phản ứng:
Fe + H2SO4 → FeSO4 + H2↑
⇒ nFe = n H 2 = 0,02 mol.
Theo đó, m = 2 × (0,015 × 64 + 0,02 × 56) = 4,16 gam
Đáp án C
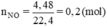
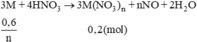
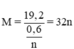 → {n = 2, M = 64)} ⇒ M là Cu
→ {n = 2, M = 64)} ⇒ M là Cu
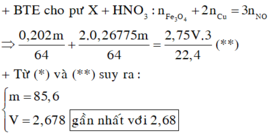


Ta có \(^nNO=\dfrac{4,48}{22,4}=0,2mol\)
3M + 4HNO3 -> 3M(NO3)n+ nNO + 2H2O.
\(^nM=\dfrac{0,6}{n}\)
MM = 32n ⟹ Chỉ có n = 2 thì MM = 64. Vậy M là Cu.
Đáp án B.