Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Axit: là những chất phân li trong nước ra ion H+
Ví dụ:
HCl → H+ + Cl-
H2S ⇌ 2H+ + S2-
- Axit một nấc: là những axit chỉ phân li một nấc ra ion H+ thí dụ như HCl, HBr…
HCl → H+ + Cl-
- Axit nhiều nấc là những axit phân li nhiều lần ra H+
Ví dụ:
| H2S là axit hai nấc | H2S ⇔ H+ + HS- HS- ⇌ H+ + S2- |
| H3PO4 là axit ba nấc | H3PO4 ⇌ H+ + H2PO4- H2PO4- ⇌ H+ + HPO42- HPO42- ⇌ H+ + PO43- |

Theo thuyết A-rê-ni-ut thì:
– Axit là chất khi tan trong nước phân li ra cation H+
Ví dụ: HCl → H+ + Cl–
– Bazơ là chất khi tan trong nước phân li ra anion OH–
Ví dụ : NaOH → Na+ + OH–
– Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Zn(OH)2 ⇔ Zn2+ +20H– ; Zn(OH)2 ⇔ ZnO2-2 + 2H+
2. Những axit mà tan trong nước phân li nhiều nấc ra ion H+ gọi là các axit nhiều nấc.
Ví dụ : H2SO4, H3PO4….
Những bazơ khi tan trong nước phân li nhiều nấc ra ion OH– gọi là các bazơ nhiều nấc. Ví dụ : Mg(OH)2, Ca(OH)2,….
3. Muối là hợp chất, khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit. Ví dụ : Na2CO3 → 2Na+ + CO32-
Muối trung hòa là muối mà anion gốc axit không có khả năng phân li ra ion H+. Muối axit là muối mà anion gốc axit có khá năng phân li ra ion H+.
Sự điện li cùa muối trong nước tạo cation kim loại (hoặc NH4+ , ion phức) và anion gốc axil.

C H 3 C O O H ↔ C H 3 C O O - + H + ( 1 )
C H 3 C O O N a phân li trong dung dịch như sau :
C H 3 C O O N a → C H 3 C O O - + N a +
Sự phân li của C H 3 C O O H là quá trình thuận nghịch. Đây là cân bằng động. Khi hoà tan C H 3 C O O N a vào thì nồng độ C H 3 C O O - tăng lên, làm cho cân bằng (1) chuyển dịch từ phải sang trái, nên nồng độ H + giảm xuống.
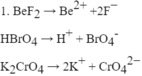
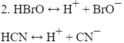
Viết phương trình điện li của các chất sau đây trong dung dịch :
1. Axit mạnh H2SeO4 (nấc thứ nhất điện li mạnh)
\(H_2SeO_4\rightarrow H^++HSeO_4^-\)
\(HSeO_4^-\leftrightarrow H^++SeO_4^{2-}\)
2. Axit yếu 3 nấc H3PO4
\(H_3PO_4\leftrightarrow H^++H_2PO_4^-\)
\(H_2PO_4^-\leftrightarrow H^++HPO_4^{2-}\)
\(HPO_4^{2-}\leftrightarrow H^++PO_4^{3-}\)
3. Hiđroxit lưỡng tính Pb(OH)2
\(Pb\left(OH\right)_2\leftrightarrow Pb^{2+}+2OH^-\)
\(Pb\left(OH\right)_2\leftrightarrow PbO_2^{2-}+2H^+\)
4. Na2HPO4
\(Na_2HPO_4\leftrightarrow2Na^++HPO_4^{2-}\)
\(HPO_4^{2-}\leftrightarrow H^++PO_4^{3-}\)
5. NaH2PO4
\(NaH_2PO_4\leftrightarrow Na^++H_2PO_4^-\)
\(H_2PO_4^-\leftrightarrow H^++HPO_4^{2-}\)
\(HPO_4^{2-}\leftrightarrow H^++PO_4^{3-}\)
6. Axit mạnh HMnO4
\(HMnO_4\rightarrow H^++MnO_4^-\)
7. Bazơ mạnh RbOH
\(RbOH\rightarrow Rb^++OH^-\)