Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Các phản ứng hoá học xảy ra trên hai đĩa cân :
CaCO 3 + 2 HNO 3 → Ca NO 3 2 + H 2 O + CO 2
MgCO 3 + 2 HNO 3 → Mg NO 3 2 + H 2 O + CO 2
Vị trí của hai đĩa cân trong thí nghiệm lần thứ nhất :
Số mol các chất tham gia ( 1 ) : n CaCO 3 = 20/100 = 0,2 mol bằng số mol HNO 3
Số mol các chất tham gia (2) : n MgCO 3 = 20/84 ≈ 0,24 mol nhiều hơn số mol HNO 3
Như vậy, toàn lượng HNO 3 đã tham gia các phản ứng (1) và (2). Mỗi phản ứng đều thoát ra một lượng khí CO 2 là 0,1 mol có khối lượng là 44 x 0,1 = 4,4 (gam). Sau khi các phản ứng kết thúc, 2 đĩa cân vẫn ở vị trí thăng bằng.

Các phản ứng hoá học xảy ra trên hai đĩa cân :
CaCO 3 + 2 HNO 3 → Ca NO 3 2 + H 2 O + CO 2
MgCO 3 + 2 HNO 3 → Mg NO 3 2 + H 2 O + CO 2
Vị trí của hai đĩa cân trong thí nghiệm lần thứ hai :
Nếu mỗi cốc có 0,5 mol HNO 3 thì lượng axit đã dùng dư, do đó toàn lượng muối CaCO 3 và MgCO 3 đã tham gia phản ứng :
Phản ứng ( 1 ) : 0,2 mol CaCO 3 làm thoát ra 0,2 mol CO 2 ; khối lượng các chất trong cốc giảm : 44 x 0,2 = 8,8 (gam).
Phản ứng (2) : 0,24 mol MgCO 3 làm thoát ra 0,24 mol CO 2 ; khối lượng các chất trong cốc giảm : 44 x 0,24 = 10,56 (gam).
Sau khi các phản ứng kết thúc, hai đĩa cân không còn ở vị trí thăng bằng. Đĩa cân thêm MgCO 3 sẽ ở vị trí cao hơn so với đĩa cân thêm CaCO 3

\(n_{Mg}=\dfrac{13.44}{24}=0.56\left(mol\right)\)
TN1 :
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0.56................................0.56\)
TN2 :
\(MCO_3+H_2SO_4\rightarrow MSO_4+CO_2+H_2O\)
\(x............................x\)
Vì cân thăng bằng nên :
\(m_{Mg}-m_{H_2}=m_{MCO_3}-m_{CO_2}\)
\(\Rightarrow13.44-0.56\cdot2=22-44x\)
\(\Rightarrow x=0.22\)
\(M_{MCO_3}=\dfrac{22}{0.22}=100\left(g\text{/}mol\right)\)
\(\Rightarrow M=100-60=40\left(g\text{/}mol\right)\)
\(M:Ca\)

2HNO3+CaCO3=Ca(NO3)2+CO2+H2O(1)
0,2mol 0,2mol 0,2mol
2HNO3+MgCO3=Mg(NO3)2+CO2+H2O(2)
0,2mol 0,1mol 0,1mol
n =0,2mol
CaCO3
n =0,24mol
MgNO3
n =0,2mol
HNO3
suy ra n =0,14mol
CaCO3dư
m1=n .M =32,8g
Ca(NO3)2 Ca(NO3)2
m2=m +m =n .M +n M
Mg(NO3)2 Mg(CO3) dư Mg(NO3)2 Mg(NO3)2 MgCO3 dư MgCO3 dư
=14,8+11,76=26,56g
vậy m1>m2 hai đĩa cân không giữ được vị trí cân bằng
Bài này phải giải như sau mới đúng:
CaCO3 + 2HNO3 ---> Ca(NO3)2 + CO2 + H2O
MgCO3 + 2HNO3 ---> Mg(NO3)2 + CO2 + H2O
a) Như vậy, ở cả 2 cốc thì HNO3 đều hết và CaCO3 cũng như MgCO3 đều dư, nên lượng CO2 thoát ra ở cả 2 cốc đều bằng nhau = 4,4 g. Do đó, khi phản ứng kết thúc 2 đĩa cân vẫn ở vị trí thăng bằng.
b) Ở cả 2 cốc lượng HNO3 đều dư, nên số mol CO2 ở cả 2 cốc phải tính theo CaCO3 và MgCO3.
Mà nMgCO3 > nCaCO3 nên lượng CO2 thoát ra ở cốc 2 nhiều hơn, do đó cân lệch về phía cốc thứ nhất.

a.
|
|
AgNO3 |
K2CO3 |
| Ban đầu |
0,6 mol; 102 gam |
0,9 mol; 124,2 gam |
| Thêm vào |
→ HCl : 0 , 1 mol ↓ AgCl : 0 , 6 mol |
← H 2 SO 4 : 0 , 25 ↑ CO 2 : 0 , 25 |
| Sau phản ứng |
115,9gam |
213,2 gam |
| Thêm nước |
213,2 – 115,9 = 97,3 gam |
|
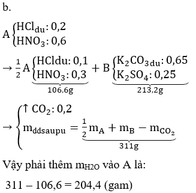

CaCO3+ H2SO4-> CaSO4+CO2+H2O
0.05 0.05
-> khối lượng bình A sau phản ứng tăng 5-0.05x44=2.8 g
cân trở lại vị trí cân bằng -> khối lượng bình B cũng tăng 2.8g
->4,787 - 44nC(X) = 2,8
-> nC(X) = nX = 1,987/44 (cái này không làm tròn thì PTK của X ra đúng hơn!)
->Mx= 106
-> A : Na2CO3