Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 7:
\(a.m_{Fe}=0,5.56=28\left(g\right)\\ b.n_{p.tử}=\dfrac{6.10^{23}}{6.10^{23}}=1\left(mol\right)\\ m_{CO_2}=44.1=44\left(g\right)\\ m_{Al_2O_3}=1.102=102\left(g\right)\\ m_{C_6H_{12}O_6}=180.1=180\left(g\right)\\ m_{H_2SO_4}=98.1=98\left(g\right)\)
Bài 8:
\(a.n_{Ca}=\dfrac{112}{40}=2,8\left(mol\right)\\ b.m_{HCl}=36,5.0,5=18,25\left(g\right)\\ c.n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)

\(m_{H_2S}=2.34=68\left(g\right)\)
\(m_{H_2SO_4}=0,25.98=24,5\left(g\right)\)
\(m_{CuO}=0,5.80=40\left(g\right)\)
áp dụng công thức : m = n.M
Ta có : \(m_{H2S}\) = 2.34 = 68 (g)
\(m_{H2SO4}\) = 0,25 .98= 24,5 (g)
\(m_{CuO}\) = 0,5 . 80 = 40 (g)

\(m_{Fe}=0,5.56=28\left(g\right)\)
\(m_{H_2SO_4}=0,75.98=73,5\left(g\right)\)
\(m_{CuSO_4}=0,6.160=96\left(g\right)\)

a) mN = 0,5 .14 = 7g.
mCl = 0,1 .35.5 = 3.55g
mO = 3.16 = 48g.
b) mN2 = 0,5 .28 = 14g.
mCl2 = 0,1 .71 = 7,1g
mO2 = 3.32 =96g
c) mFe = 0,1 .56 =5,6g mCu = 2,15.64 = 137,6g
mH2SO4 = 0,8.98 = 78,4g.
mCuSO4 = 0,5 .160 = 80g

a) \(\left\{{}\begin{matrix}n_{HCl}=0,5\\n_{H_2SO_4}=0,19\end{matrix}\right.\)
Gọi công thức chung của 2 axit là HX
=> nHX = 0,5 + 0,19.2 = 0,88 (mol)
\(n_{H_2}=\dfrac{8,736}{22,4}=0,39\left(mol\right)\)
Do nHX > 2.nH2 => axit còn dư sau pư
b) bài này s tính riêng đc mỗi muối :v
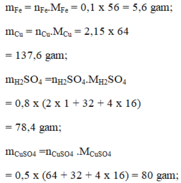

thay vì :'m 0,5 mol H2SO4 =' thì bn nên đánh là 'khối lượng của 0,5 mol H2SO4 là' thì sẽ hay hơn