Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

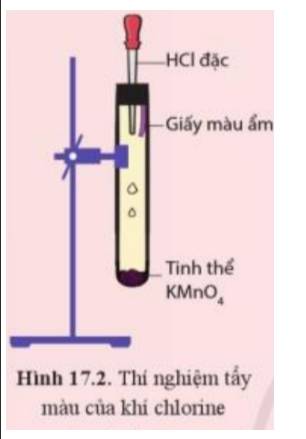
- Hiện tượng: Xuất hiện khí màu vàng và giấy màu ẩm bị nhạt màu dần rồi mất màu
- Giải thích:
+ Khi nhỏ HCl đặc vào tinh thể KMnO4, sản phẩm tạo thành có khí chlorine:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
+ Khí chlorine tác dụng với nước ở giấy màu ẩm tạo thành hỗn hợp có tính tẩy màu: HCl và HClO
Cl2(aq) + H2O(l) \( \rightleftharpoons \) HCl(aq) + HClO(aq)
=> Dung dịch này còn được gọi là dung dịch nước chlorine, có tính tẩy màu, sát khuẩn

- Thí nghiệm 1:
+ Khi cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu thì tạo ra dung dịch màu vàng nâu của bromine:
Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq)
+ Khi nhỏ 2 mL cyclohexane vào ống nghiệm, quan sát thấy màu vàng nâu của bromine nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
- Thí nghiệm 2:
+ Khi cho nước bromine màu vàng vào dung dịch sodium iodine không màu thì tạo ra dung dịch màu vàng:
Br2(aq) + 2NaI(aq) → 2NaBr(aq) + I2(aq)
+ Khi cho thêm 2 mL cyclohexane thấy màu dung dịch nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
+ Khi thêm tiếp vài giọt hồ tinh bột thì thấy dung dịch từ màu vàng chuyển sang màu xanh tím do iodine tác dụng với hồ tinh bột

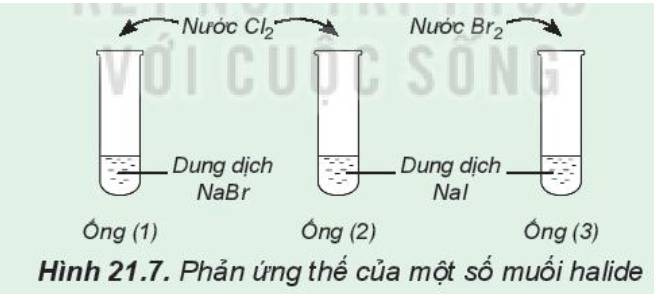
1:
Ống nghiệm (1); dung dịch chuyển sang màu vàng
ống nghiệm (2): dung dịch có màu vàng và có chất rắn màu đen tím
ống nghiệm (3): dung dịch màu vàng nhạt dần và có chất rắn màu đen tím
2: Tính oxi hóa: Cl>Br
=>Cl đẩy Br- ra khỏi dung dịch muối
Tính oxi hóa; Br>I2
=>Br đẩy I- ra khỏi dung dịch muối
=>Tính oxi hóa; Cl2>Br2>I2
3: Để chứng tỏ có sự tạo thành I2 khi cho nước clo (hoặc nước brom) tác dụng với dung dịch sodium iốt ta có thể dùng thuốc thử là hồ tinh bột vì I2 tạo màu xanh đặc trưng với hồ tinh bột.

Sau khi nhỏ nhanh vài giọt bromine vào ống nghiệm chứa nước, dung dịch bromine có những chất: Br2, H2O, HBr, HBrO.
Br2(aq) + H2O(l) \( \rightleftharpoons \) HBr(aq) + HBrO(aq)
- Vì phản ứng xảy ra thuận nghịch nên trong dung dịch có cả chất tham gia và chất sản phẩm

- Ta có phương trình: 2H2O2 → 2H2O + O2↑
=> Dung dịch H2O2 3% ở điều kiện thường phân hủy chậm và có khí không màu thoát ra, khí đó là Oxygen
- Khi có chất xúc tác, khí thoát ra nhiều hơn
=> Chất xúc tác MnO2 làm tăng tốc độ phân hủy H2O2

1: \(AgNO_3+NaI\rightarrow NaNO_3+AgI\downarrow\)
\(AgNO_3+NaCl\rightarrow NaNO_3+AgCl\downarrow\)
\(AgNO_3+NaBr\rightarrow NaNO_3+AgBr\downarrow\)
2: nếu xuất hiện kết tủa trắng thì ống nghiệm đó là NaCl
nếu xuất hiện kết tủa vàng nhạt thì ống nghiệm đó là NaBr
nếu xuất hiện kết tủa vàng đậm thì ống nghiệm đó là NaI
nếu ko xuất hiện kết tủa thì ống nghiệm đó là NaF
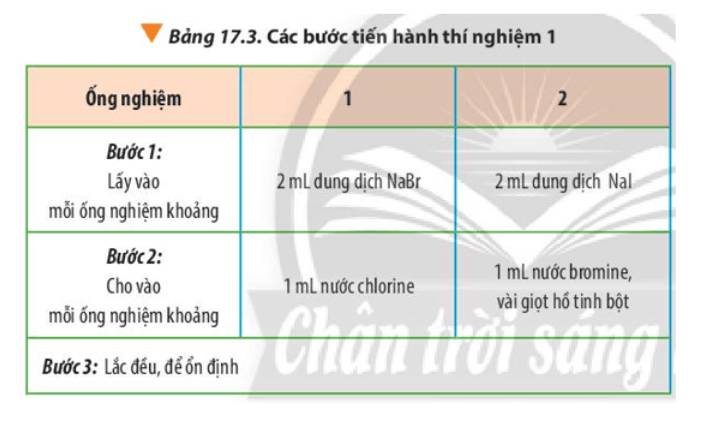
- Ống nghiệm 1: dung dịch không màu chuyển thành màu vàng nhạt
- Ống nghiệm 2: dung dịch không màu chuyển thành vàng, khi cho hồ tinh bột (không màu) thì dung dịch chuyển màu xanh tím