Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

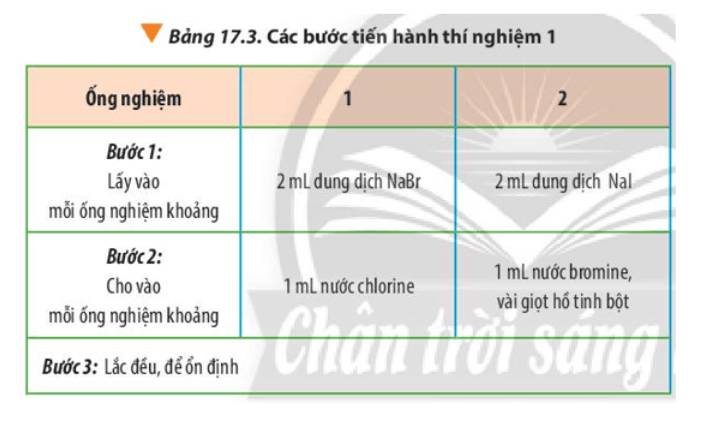
- Thí nghiệm 1:
+ Khi cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu thì tạo ra dung dịch màu vàng nâu của bromine:
Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq)
+ Khi nhỏ 2 mL cyclohexane vào ống nghiệm, quan sát thấy màu vàng nâu của bromine nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
- Thí nghiệm 2:
+ Khi cho nước bromine màu vàng vào dung dịch sodium iodine không màu thì tạo ra dung dịch màu vàng:
Br2(aq) + 2NaI(aq) → 2NaBr(aq) + I2(aq)
+ Khi cho thêm 2 mL cyclohexane thấy màu dung dịch nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
+ Khi thêm tiếp vài giọt hồ tinh bột thì thấy dung dịch từ màu vàng chuyển sang màu xanh tím do iodine tác dụng với hồ tinh bột

Chọn A
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Hiện tượng: Màu tím biến mất, dung dich chuyển sang màu vàng nhạt.

- Ống nghiệm 1: dung dịch không màu chuyển thành màu vàng nhạt
- Ống nghiệm 2: dung dịch không màu chuyển thành vàng, khi cho hồ tinh bột (không màu) thì dung dịch chuyển màu xanh tím

1: đầu tiên nước dd brom mất màu sau đó xuất hiện kết tủa trắng
SO\(_2\)2 + Br2 = H2SO4 + HBr
H2SO4 + BaCl = HCl + BaSO4(kết tủa)
2: xuất hiện khí mùi khai
NaOH + NH4HCO3 = NaHCO3 + NH3(khí) + H2O
3: xuất hiện khí không màu
Cu + H2SO4 = CuSO4 + SO2 + H2O \(\rightarrow\)

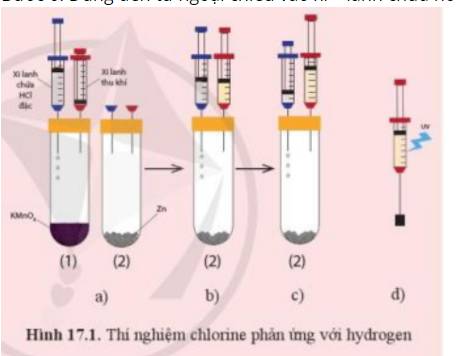
a)
- Ở Bước 2: Ta thu được khí chlorine
- Ở Bước 4: Ta thu được khí hydrogen
=> Trong xi – lanh là hỗn hợp kí chlorine và hydrogen
- Khi chiếu đèn tử ngoại vào xi – lanh hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi - lanh chứa hỗn hợp khí chlorine và hydrogen sẽ gây ra hiện tượng nổ
- Phương trình hóa học: H2 + Cl2 → 2HCl
b) Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen không xảy ra hiện tượng như trên.
- Giải thích: Phản ứng giữa H2 và I2 cần đun nóng để phản ứng diễn ra, là phản ứng thuận nghịch, tạo hỗn hợp gồm HI sinh ra và lượng H2, I2 còn lại. Khả năng phản ứng kém nên không có hiện tượng nổ
H2 + I2 \( \rightleftharpoons \) 2HI

Clo đẩy brom ra khỏi muối :
Cl 2 + 2NaBr → NaCl + Br 2
Brom tan vào nước tạo ra dung dịch màu vàng.
Tiếp tục cho clo đi vào thì nó oxi hoá brom :
5 Cl 2 + Br 2 + 6 H 2 O → 2HBr O 3 + 10HCl
Các axit tạo thành không màu, dung dịch của chúng là quỳ tím hoá đỏ.
Sau khi nhỏ nhanh vài giọt bromine vào ống nghiệm chứa nước, dung dịch bromine có những chất: Br2, H2O, HBr, HBrO.
Br2(aq) + H2O(l) \( \rightleftharpoons \) HBr(aq) + HBrO(aq)
- Vì phản ứng xảy ra thuận nghịch nên trong dung dịch có cả chất tham gia và chất sản phẩm