Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

V sau pư = 56 l => V thực tế pư = 56 – 40 = 16 l
H% = 16 : 40 .100% = 40%
Đáp án A

Đáp án A
V sau pư = 56 l => V thực tế pư = 56 – 40 = 16 l
H% = 16 : 40 .100% = 40%

Đáp án A
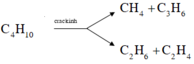
+ Phản ứng crackinh butan:
+ Suy ra: n s ả n p h ẩ m = 2 n C 4 H 10 p ư ⇒ n C 4 H 10 p ư = n k h í t ă n g l ê n = n h h s p ư - n a n k a n b đ
+ n C 4 H 10 b đ = 1 H = x % ⇒ n k h í t ă n g = n C 4 H 10 p ¨ o = 0 , 01 x n X = n C 4 H 10 b đ + n t ă n g = 1 + 0 , 01 x + B T K L : m C 4 H 10 b đ = m X ⇒ 58 = ( 1 + 0 , 01 x ) . 32 , 65 ⇒ x = 77 , 64 ⇒ H = 77 , 64 %

Lấy x=1 mol
*Crackinh C4H10:
Các phương trình hóa học:
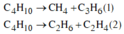
![]()
![]()
![]()
![]()
=> X gồm CH4, C2H6, C2H4, C3H6 và C4H10 dư
*Cho X qua dung dịch Br2 dư thì các hiđrocacbon không no (C2H4, C3H6) bị hấp thụ:

=> Hỗn hợp khí Y thu được gồm CH4, C2H6, C4H10 dư
*Đốt cháy hỗn hợp Y:
Đặt số mol các chất là CH4: a mol; C2H6: b mol
![]()
Sơ đồ phản ứng: 
![]()

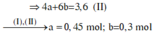
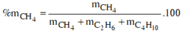
![]()
Đáp án A.

Chọn đáp án A
Giả sử x = 1. ⇒ nC4H10 dư = 0,25 mol.
⇒ nCH4 + nC2H6 = nC4H10 pứ = 0,75 mol. Y gồm CH4 và C3H6 và C4H10 dư.
nH2O = 3,05 = 2nCH4 + 3nC3H6 + 5 × 0,25. Giải hệ có: nCH4 = 0,45 mol; nC2H6 = 0,3 mol.
⇒ %mCH4/Y = 0,45 × 16 ÷ (0,45 × 16 + 0,3 × 30 + 0,25 × 58) × 100% = 23,45%.


Đáp án A
Các khi đo ở cùng điều kiện nên
xem thể tích như số mol.
C4H10 → c r a c k i n h anken + ankan
10 0 0
x x x
10-x x x
→ nsau phản ứng = 10 + x = 18 → x = 8 → H = 80%.