Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
n C r 2 O 3 = 0 , 03 m o l
Cho toàn bộ X tác dụng với HCl loãng nóng thu được 0,12 mol H2.
Ta thấy 0 , 12 > n C r = 0 , 06 do vậy Al dư
Vậy X chứa Cr 0,06 mol, Al2O3 0,03 mol và Al dư
→ n A l = 0 , 12 - 0 , 06 1 , 5 = 0 , 04 m o l
X tác dụng với lượng dư NaOH
→ n N a O H = 0 , 03 . 2 + 0 , 04 = 0 , 1 m o l

Chứng minh được Al dư,
Áp dụng định luật bảo toàn e: Khi Al p.ư với Cr2O3, 3nAlp.ư = 2.3.nCr2O3 → nAlp.ư = 0,06 mol.
Khi Al dư và Al2O3 p.ư với HCl: 3nAl dư + 2nCr = 2nH2 → nAl dư = 0,02 mol.
Vậy tổng số mol Al là 0,08 mol. Sau tất cả các p.ư Al chuyển thành NaAlO2 nên nNaOH = 0,08.

Đáp án C
Cr2O3 + 2Al → t 0 Al2O3 + 2Cr
Phần 2: + NaOH đặc nóng → 0,075 mol H2
![]()
Phần 1: + HCl loãng, nóng → 0,15 mol H2
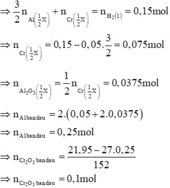
Có 0 , 1 1 < 0 , 25 2 => tính hiệu suất theo lượng Cr2O3 phản ứng.
![]()

Đáp án A
Cho toàn bộ Y tác dụng với 0,9 mol HCl thu được 0,15 mol H2 và 0,06 mol Cu không tan
Vậy dung dịch X chứa AlCl3 0,16 mol, CuCl2 0,04 mol, CrCl3 0,06 mol
![]()
Bảo toàn Cl:
![]() = 0,16
= 0,16
![]() = 1,12 mol
= 1,12 mol

Y + 0,9 mol HCl → 0,15 mol H2 + 0,06 mol Cu không tan
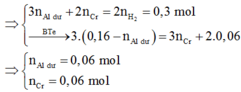
=> Dung dịch Z chứa: AlCl3 (0,16 mol), CrCl2 (0,06 mol), CrCl3 (0,06 mol), CuCl2 (0,04 mol), HCl dư (0,04 mol)
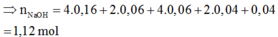
=> Chọn đáp án D

nHCl cần = 2nO trong oxit = 0,24 mol → nHCl đã dùng (dư 25%) = 0,3 mol.
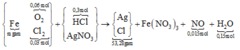
Ghép cụm có nH2O = nO trong oxit + 2nNO
→ nNO = 0,015 mol.
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa
→ về nguyên tố nAg trong tủa = 0,375 mol
Bảo toàn N có nFe(NO3)3 = (0,375 – 0,015) ÷ 3 = 0,12 mol.
→ Yêu cầu m = mFe = 0,12 × 56 = 6,72 gam.
Đáp án A

Đáp án A
Ta có nHCl cần dùng = 2∑nO trong oxit = 0,24 mol → ∑nHCl đã dùng (dư 25%) = 0,3 mol.
* Gộp cả quá trình có sơ đồ:
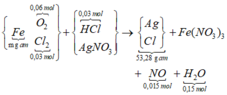
Ghép cụm NO3 bảo toàn O hoặc bảo toàn electron mở rộng ta có:
![]()
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa → về mặt nguyên tố ∑nAg trong tủa = 0,375 mol.
→ Bảo toàn nguyên tố N có
![]()
Theo đó, m gam Fe ban đầu tương ứng với 0,12 mol → m = 0,12 × 56 = 6,72 gam.

