Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{hhkhí}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
Gọi \(n_{SO_2}=a\left(mol\right)\left(0< a< 0,75\right)\)
\(\rightarrow n_{O_2\left(dư\right)}=0,75-b\left(mol\right)\)
Ta có: \(\dfrac{64a+32\left(0,75-a\right)}{0,75}=\dfrac{33,6}{1}=33,6\left(\dfrac{g}{mol}\right)\)
\(\rightarrow a=0,0375\left(mol\right)\)
\(\rightarrow\left\{{}\begin{matrix}\%V_{SO_2}=\dfrac{0,0375}{0,75}=5\%\\\%V_{O_2\left(dư\right)}=100\%-5\%=95\%\end{matrix}\right.\)

a) Phương trình hóa học S + O2 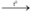 SO2
SO2
b) nS = 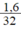 = 0,05 mol.
= 0,05 mol.
Theo phương trình trên, ta có:
nSO2 = nS = nO2 = 0,05 mol.
⇒ VSO2 = 0,05 .22,4 = 1,12 l.
⇒ VO2 = 22,4.0,05 = 1,12 l
Vì khí oxi chiếm 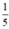 thể tích của không khí nên thể tích không khí cần là
thể tích của không khí nên thể tích không khí cần là
⇒ Vkk = 5VO2 = 5.1,12 = 5,6 l

a)
- Hiện tượng: Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong oxi mãnh liệt hơn
S + O2 --to--> SO2 (pư hóa hợp)
Sản phẩm: Lưu huỳnh đioxit
b)
- Hiện tượng: Sắt cháy mạnh, sáng chói, tạo ra các hạt nhỏ nóng chảy màu nâu
3Fe + 2O2 --to--> Fe3O4 (pư hóa hợp)
Sản phẩm: Sắt từ oxit
a,S+O2to⟶SO2S+O2⟶toSO2 Hiện tượng :Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong khí oxi mãnh liệt hơn, tạo thành khí lưu huỳnh đioxit và rất ít lưu huỳnh trioxit . Chất rắn màu vàng Lưu huỳnh dần chuyển sang thể hơi.
b,3Fe+2O2to⟶Fe3O43Fe+2O2⟶toFe3O4 Hiện tượng :Khi mẩu than cháy trước tạo nhiệt độ đủ cao cho sắt cháy. Sắt cháy mạnh, sáng cói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, công thức hoá học là Fe3O4 thường được gọi là oxit sắt từ. Màu trắng xám của Sắt dần chuyển sang màu nâu thành hợp chất Oxit sắt từ.

bài tập 2
3Fe + 2O2 -\(-^{t^o}->\) Fe3O4 (1)
ADCT n= m/M
\(n_{fe_3O_4}\)= 11,6/ 232= 0,05 mol
Theo pt(1) có
\(\dfrac{n_{O2}}{n_{Fe3O4}}\)=\(\dfrac{2}{1}\)
-> \(n_{O2}\)= 2/1 x \(n_{fe3o4}\)
= 0,1 mol
ADCT V= n x 22,4
Vo2= 0,1 x 22,4
= 2,24 (l)
bài tập 4
OXIT AXIT:
- CO2: Cacbon đi oxit
- N2O: đi ni tơ oxit
- SO3: Lưu huỳnh tri oxit
- CO: cacbon oxit
P2O5: đi photpho penta oxit
NO2: Nitơ đi oxit
OXIT BA ZƠ
- HgO: thủy ngân (II) oxit
- MgO: Magie oxit
- FeO: sắt (II) oxit
- Li2O: liti oxit
-CaO: canxi oxit
- BaO: bari oxit
- Na2O: natri oxit
- Al2O3 : Nhôm oxit
ZnO: kẽm oxit

Định luật bảo toàn khối lượng :
\(m_S+m_{O2}=m_{SO2}\)
3,2 + \(m_{O2}\) = 6,4
⇒ \(m_{O2}=6,4-3,2=3,2\left(g\right)\)
Chúc bạn học tốt
\(BTKL: \\ m_S+m_{O_2}=m_{SO_2}\\ 3,2+m_{O_2}=6,4\\ m_{O_2}=6,4-3,2=3,1(g)\)

1. Khí hidro cháy trong không khí tạo ra nước
\(2H_2+O_2\rightarrow2H_2O\) ( có nhiệt độ )
2. Lưu huỳnh cháy trong bình chứa khí oxi tạo ra lưu huỳnh khí oxi(Biết trong hợp chất S có hóa trị IV)
\(S+O_2\rightarrow SO_2\) ( có nhiệt độ )
3. Phân hủy canxi cacbonat thành canxi oxi và khí cacbonic
\(CaCO_3\rightarrow CaO+CO_2\)
4, Cho bari hidroxit và lọ đựng nhôm sunfat sinh ra 2 chất rắn mới là bari sunfat và nhôm hidrxit
\(Al_2\left(SO_4\right)_3+3Ba\left(OH\right)_2\rightarrow2Al\left(OH\right)_3\downarrow+3BaSO_4\downarrow\)
5. Natri cho vào lọ đựng nước thu được natri hidroxit và khí hidro
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
Chất rắn dần dần chuyển thành chất khí mùi độc(SO2)
Khi cháy thì lưu huỳnh cháy ở trong oxi mãnh liệt hơn trong kk
S + O2 \(\underrightarrow{t^o}SO_2\)
2SO2 + O2 \(\underrightarrow{t^o}\)2SO3
Ta có PTHH \(S+O_2\underrightarrow{t^0}SO_2\)
Hiện tượng : Lưu huỳnh cháy sáng