Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Lực đẩy của nước tác dụng vào hai thỏi tính bằng công thức:
F1 = d.V1; F2 = d.V2 (trong đó d là trọng lượng riêng của nước, V1 là thể tích của thỏi nhôm, V2 là thể tích của thỏi đồng)
Vì hai thỏi có trọng lượng như nhau: P1 = P2 và trọng lượng riêng của đồng lớn hơn của nhôm d1 < d2 nên V1 > V2, do đó F1 > F2.
Vậy cân sẽ không cân bằng nữa khi nhúng ngập cả hai thỏi đồng thời vào hai bình đựng nước.
F1 = d.V1; F2 = d.V2 (trong đó d là trọng lượng riêng của nước, V1 là thể tích của thỏi nhôm, V2 là thể tích của thỏi đồng)
Vì hai thỏi có trọng lượng như nhau: P1 = P2 và trọng lượng riêng của đồng lớn hơn của nhôm d1 < d2 nên V1 > V2, do đó F1 > F2.
Vậy cân sẽ không cân bằng nữa khi nhúng ngập cả hai thỏi đồng thời vào hai bình đựng nước.

`#3107.101107`
a)
V của NH3 ở điều kiện chuẩn là:
\(\text{V}_{\text{NH}_3}=\text{n}_{\text{ }\text{NH}_3}\cdot24,79=0,2\cdot4,958\left(l\right)\)
Vậy, thể tích của NH3 ở đkc là `4,958` l.

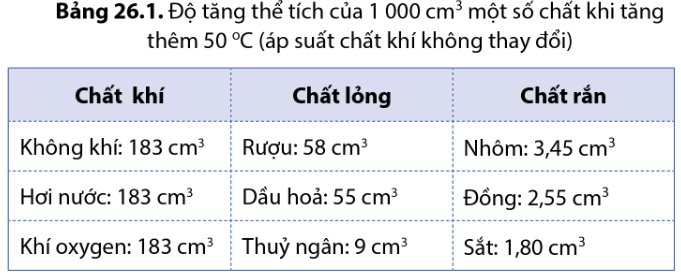
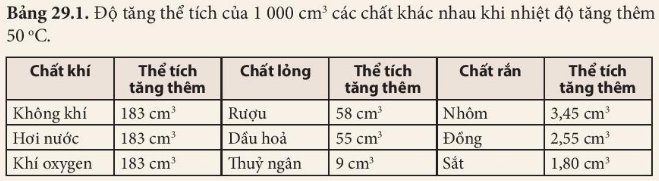
Các chất khí khác nhau nở vì nhiệt giống nhau
Các chất rắn khác nhau nở vì nhiệt khác nhau
Các chất lỏng khác nhau nở vì nhiệt khác nhau
Chất khí có thể nở rất nhiều, và khi nhiệt độ tăng lên đáng kể, chất khí có thể nở tới hàng trăm lần kích thước ban đầu của nó.

Ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25oC), thể tích 1 mol khí là 24,79 lít.
1 mol khí ở đkc (1bar, 25oC) có thể tích 24,79 lít

a) Zn + 2HCl → ZnCl2 + H2
b) 25oC và 1bar ⇒ đkc
nZn = \(\dfrac{19,5}{65}\)= 0,3(mol)
nH2 = \(\dfrac{0,3.1}{1}\)=0,3(mol)
VH2 = 0,3 . 24,79 = 7,437(l)
c) 200 ml = 0,2l
CM ZnCl2 = \(\dfrac{0,3}{0,2}\)=1,5M

\(n_{CO_2}=\dfrac{V}{24,79}=0,2\left(mol\right)\)
PTHH: \(R_2CO_3+2HCl\rightarrow2RCl+CO_2+H_2O\)
Mol: 0,2 0,2
\(\Rightarrow n_{R_2CO_3}=0,2\left(mol\right)\)
Mặt khác: \(n_{R_2CO_3}=\dfrac{m}{M}\Rightarrow\dfrac{m}{M}=0,2\)
\(\Rightarrow M=\dfrac{m}{0,2}\Leftrightarrow2R+12+3\cdot16=\dfrac{21,2}{0,2}\)
\(\Rightarrow R=23=Na\)
\(\Rightarrow\left\{{}\begin{matrix}\%Na=\dfrac{2M_{Na}}{M}\cdot100\%=\dfrac{2\cdot23}{23\cdot2+12+16\cdot3}\cdot100\%\approx43,4\%\\\%O=\dfrac{3M_O}{M}\cdot100\%=\dfrac{3\cdot16}{23\cdot2+12+16\cdot3}\cdot100\%\approx45,3\%\\\%C=100\%-\%Na-\%O\approx11,3\%\end{matrix}\right.\)

Phương trình hoá học: 4Al + 3O2 → 2Al2O3.
Số mol Al tham gia phản ứng:
n Al = mAl : M Al = 0,54 : 27 = 0,02 mol
a) Từ phương trình hóa học ta có:
n Al2O3 = ½ n Al = 0,02 : 2 = 0,01 mol
n Al2O3 = 0,01 x 102 = 10,2 gam
b) theo phương trình hóa học ta có:
n O2 = ¾ n Al = ¾ x 0,02 = 0,015 mol
V O2 (đkc) = 0,015 x 24,79 = 0,37185 (lít)
\(PTHH:4Al+3O_2\left(t^o\right)\rightarrow2Al_2O_3\\ n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\Rightarrow n_{Al}=\dfrac{2}{4}.0,02=0,01\left(mol\right);n_{O_2}=\dfrac{3}{4}.0,02=0,15\left(mol\right)\\ a,m_{Al_2O_3}=0,01.27=0,27\left(g\right)\\ b,V_{O_2\left(đkc\right)}=0,15.24,79=3,7185\left(l\right)\)



\(k_1=\dfrac{V_1}{n_1}=\dfrac{4,958}{0,2}=24,790\\ k_2=\dfrac{V_2}{n_2}=\dfrac{12,395}{0,5}=24,790\\ k_3=\dfrac{V_3}{n_3}=\dfrac{24,790}{1}=24,790\\ k_4=\dfrac{V_4}{n_4}=\dfrac{49,580}{2}=24,790\\ Vậy:k_1=k_2=k_3=k_4=24,79\\ \Rightarrow n=\dfrac{V_{\left(đkc\right)}}{24,79}\)