Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TN1 Fe ---> Fe
x x mol
FeO+ H2 ---> Fe + H2O
y y
Fe2O3 + 3H2---> 2Fe + 3H2O
z 2z
=> 56x + 72y+ 160z=2,36
TN2 Fe + CuSO4---> FeSO4+ Cu
x x mol
FeO và Fe2O3 không tác dụng
=> 64x+ 72y+ 16O z=2,48
lại có 56x+ 72y+ 160z=2,36
giả hệ 3 pt => x=0,015 ,y= 0,01 , z=0,005
=> mFe=0,84 gan , mFeO=0,72 gam, mFe2O3=0,8 gam.

A, Gọi X,y lần lượt là số mol của Mg và Al
Pthh:
Mg + H2SO4---> MgSO4 + H2
X. X. X. X
2Al + 3H2SO4---> Al2(SO4)3+3H2
Y. 1.5y. Y. 1.5y
Ta có pt:
24x + 27y= 1.95
X+1.5y=2.24/22.4=0.1
=> X=0.025, Y=0.05
%Mg= 0.025×24×100)/1.95=30.8%
%Al= 100%-30.8%=69.2%
mH2SO4= 0.025+1.5×0.05=0.1g
mH2= (0.025+0.05)×2=0.15g
C, Mdd H2SO4 = 0.1/6.5×100=1.54g
MddY= 1.54+1.95-0.15=3.34g
%MgSO4 vs %Al2(SO4)3 b tự tính nha

Bài 1 :
nFe = 0,25 mol; nAgNO3 = 0,2 mol; nCu(NO3)2 = 0,05 mol.
Giữa Ag+ và Cu2+ thì Ag+ có tính oxi hóa mạnh hơn Cu2+, nên Ag+ tham gia phản ứng với Fe trước, sau khi Ag+ tham gia phản ứng hết nếu còn dư Fe thì Cu2+ mới tiếp tục tham gia.
Fe + 2Ag+ → Fe2+ + 2Ag (VII)
nFe = 0,25 mol; nAg+ = 0,2 mol → Fe dư sau phản ứng (VII)
Fe + 2Ag+ → Fe2+ +2Ag
0,1 (mol) 0,2 (mol) 0,1 (mol) 0,2 (mol)
Sau phản ứng (VII) ta có: nFe còn = 0,25 – 0,1 = 0,15 mol, Ag tạo thành = 0,2 mol.
Fe + Cu2+ → Fe2+ + Cu (VIII)
nFe = 0,15 mol; nCu2+ = 0,05 mol → Fe vẫn còn dư sau phản ứng (VIII)
Fe + Cu2+ → Fe2+ + Cu
0,05 (mol) 0,05 (mol) 0,05 (mol) 0,05 (mol)
Vậy, sau phản ứng (VII) và (VIII), chất rắn thu được gồm nAg = 0,2 mol; nCu = 0,05 mol và nFe dư = 0,25 – (0,1 + 0,05) = 0,1 mol.
Nên ta có giá trị của m = mAg + mCu + mFe dư
= 0,2.108 + 0,05.64 + 0,1.56 = 30,4 gam.
Bài 2 :
Nhận xét :
- Mg sẽ tác dụng với AgNO3 trước, sau khi AgNO3 hết thì Mg mới phản ứng với Cu(NO3)2.
- Vì chưa biết khối lượng Mg tham gia là bao nhiêu, nên bài toán này ta phải chia ra các trường hợp:
+ Mg tham gia vừa đủ với AgNO3, Cu(NO3)2 chưa tham gia, chất rắn thu được là Ag tính được giá trị m1.
+ AgNO3, Cu(NO3)2 tham gia hết, Mg phản ứng vừa đủ, chất rắn tham gia gồm Ag, Cu có giá trị là m2.
Nếu khối lượng chất rắn trong 2 trường hợp nằm trong khoảng m1< 17,2 < m2 (từ dữ kiện đề bài, tính toán giá trị m1, m2) có nghĩa là Ag+ tham gia phản ứng hết, Cu2+ tham gia một phần.
Đáp số : m = 3,6gam.

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam

\(2A+nCI2\rightarrow2ACIn\)
\(nA=\frac{1.96}{M}\)
\(nACI2=\frac{5,6875}{\left(M+35,5n\right)}\)
\(nA=nACI2\)
\(\Rightarrow\frac{1,96}{M}=\frac{5,6875}{\left(M+35,5n\right)}\)
\(\Rightarrow M=\frac{56}{3n}\)
\(\Rightarrow n=1\) \(M=\frac{56}{3}\left(Loại\right)\)
\(n=2\) \(M=\frac{112}{3}\left(Loại\right)\)
\(n=3\) \(M=56\)
Vậy A là Fe
\(Fe+HCI\rightarrow FeCI2+H2\)
\(FexOy+\frac{HCI\rightarrow FeCI2y}{x+H2O}\)
\(FexOy+H2\rightarrow Fe+H2O\)
Goi a b lần lượt là số mol của Fe và FexOy trong 4,6 gam hỗn hợp
\(nFe=a\Rightarrow nHCI=2a\)
\(nFexOy=b\Rightarrow nHCI=2by\)
\(nHCI=0,08\cdot2=1,6mol\)
\(\Rightarrow2a+2by=0,16\)
\(\Rightarrow a+by=0,08\left(1\right)\)
\(56a+b\left(56x+16y\right)=4,6\Rightarrow56a+56bx+16by=4,6\left(2\right)\)
Chất rắn X là Fe
\(nFexOy=b\)
=> nFe sinh ra là bx
\(\Rightarrow56a+56bx=3,64\left(3\right)\)
Từ (1) (2) và (3) ta có hệ:
\(\begin{cases}a+by=0,08\\56a+56bx+16by=4,6\\56a+56bx=3,64\end{cases}\)
\(a=0,02\\
bx=0,045\\
by=0,06\)
\(\frac{\Rightarrow bx}{by}=\frac{x}{y}=\frac{0,045}{0,06}=\frac{3}{4}\)
=> Công thức của oxit cần tìm là: Fe3O4
2A+nCl2 -------------->2ACln
nA=1.96/M
nACl2=5,6875/(M+35,5n)
nA=nACl2
=> 1,96/M=5,6875/(M+35,5n)
=>M=56/3n
=> n=1 M=56/3 (Loại)
n=2 M=112/3 (Loại)
n=3 M=56
Vậy A là Fe
Fe+HCl--->FeCl2+H2
FexOy+HCl---->FeCl2y/x+H2O
FexOy+H2---->Fe+H2O
Goi a b lần lượt là số mol của Fe và FexOy trong 4,6 gam hỗn hợp
nFe=a=>nHCl=2a
nFexOy=b=>nHcl=2by
nHCl=0,08*2=1,6 mol
=> 2a+2by=0,16
=> a+by=0,08 (1)
56a+b(56x+16y)=4,6=> 56a+56bx+16by=4,6 (2)
Chất rắn X là Fe
nFexOy=b
=> nFe sinh ra là bx
=> 56a+56bx=3,64 (3)
Từ (1) (2) và (3) ta có hệ:
{a+by=0,08
{56a+56bx+16by=4,6
{56a+56bx=3,64
a=0,02
bx=0,045
by=0,06
=> bx/by=x/y=0,045/0,06=3/4
=> Công thức của oxit cần tìm là: Fe3O4

Fe+2HCl--->FeCl2+H2 (1)
Fe2O3+6HCl-->2FeCl3+3H2O (2)
FeCl2+2NaOH-->Fe(OH)2+NaCl (3)
FeCl3+3NaOH-->Fe(OH)3+3NaCl (4)
4Fe(OH)2+O2-->2Fe2O3+4H2O (5)
2Fe(OH)3-->Fe2O3+3H2O (6) nH2=0,1mol-->nFe(1)=0,1mol-->mFe(1)=5,6g
nFe=0,1mol-->nFe2O3 tạo ra bởi Fe ban đầu là
0,05mol
-->mFe2O3=8g
-->mFe2O3(6)=16g
-->nFe2O3 ban đầu là 0,1mol -->mhh=5,6+16=21,6g
Ta thấy chỉ có Fe tác dụng với HCl tạo ra khí H 2 nên số mol H 2=0,1 (mol) >n Fe = 0,1(mol)>>mFe =5,6
Ta thấy khối lượng chất rắn là Fe2O3 và bằng 24 >a=29,6

Câu 1:
c) CM (HCl) dư = \(\frac{0,11}{0,25}\) = 0,44 (M)
ddAgồm \(\begin{cases}HCl:0,11mol\\AlCl_3:0,1mol\\CuCl_2:0,045mol\end{cases}\)
d) Các pư xảy ra theo thứ tự:
Mg + 2HCl \(\rightarrow\) MgCl2 + H2 (1)
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (2)
3Mg + 2AlCl3 \(\rightarrow\) 3MgCl2 + 2Al (3)
Giả sử CR chỉ gồm Cu => ko xảy ra pt(3)
nCu = \(\frac{1,92}{64}\) = 0,03 (mol)
Theo pt(1) nMg= \(\frac{1}{2}\) nHCl = 0,055 (mol)
PT(2) nCu < nCuCl2 (0,03 < 0,045 )
=> CuCl2 dư
=> Giả sử đúng
mMg = (0,055 + 0,03) . 24 =2,04 (g)
Câu 3: a) Hiện tượng: Khi sục khí Cl2 vào nước vừa có tính chất vật lí , vừa tính chất hóa học:
- Vật lí: Có một phần khí tan trong nước
- Hóa học: Có chất mới tạo thành
PT: Cl2 + H2O \(\rightarrow\) HCl + HClO
b) Hiện tượng: tạo thành chất khí, cháy ở nhiệt độ cao hoặc có ánh sáng
PT: Cl2 + H2 \(\underrightarrow{t^0}\) 2HCl (khí)

Gọi số mol của CuO và Al 2 O 3 lần lượt là a và b mol
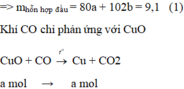
Hỗn hợp chất rắn sau phản ứng gồm Cu (a mol) và Al 2 O 3 (b mol)
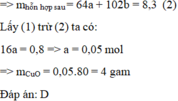
A l 2 O 3 không tác dụng với CO.
Khối lượng chất rắn giảm là khối lượng O trong CuO.
⇒ m O / C u O = m O x i t - m r a n
= 9,1 - 8,3 = 0,8g
⇒ n O / C u O = n C u O = 0,8/16 = 0,05 mol
⇒ m C u O = 0,05.80 = 4g
⇒ Chọn D.