Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Áp dụng ĐLBT điện tích
0,07 - 2x - 0,1 = 0 =>x=0,015 mol
y + 2z =0,02
trộn X với Y có H+ >< OH- Ba2+ >< SO42-
dd có pH=2 => dd có mt axit => H+ dư OH- hết => \(\left[H^+\right]\)=0,01 => nH+=0,005
H+ + OH- ------> H2O
bđ y 0,1
pư 0,1 <- 0,1
spư y-0,1
=> y - 0,1 = 0,005 => y = 0,105 mol =.> z =
có sai đề k bạn

Đáp án C
Bảo toàn điện tích: 2x = 0,05 + 0,12 – 0,12 ⇒ x = 0,025
Ba2+ + SO42- → BaSO4
0,025 ← 0,025 → 0,025 (mol)
NH4+ + OH- → NH3 + H2O
0,05 → 0,05 → 0,05 0,05 ( mol)
mchất rắn = mX + mBa(OH)2 – mBaSO4 – mNH3 – mH2O = 7,875g

Theo BTĐT: x = ( 0,12 + 0 ,05 - 0,12):2 = 0,025 (mol)
Cho 0 ,03 Ba(OH)2 vào dd X
Ba2+ + SO42- --->BaSO4
NH4+ OH- ---> NH3 +H2O
=> m = 7,875g

AD ĐLBT e, ta có:
0,12.1 + 0,05.1 = 0,12.1 + x.2
=> x = 0,025 (mol)
Cho Ba(OH)2 vào dd X
nBa2+ = 0,3.0,1 = 0,03
nOH- = 0,3.0,1.2 = 0,06
Ba2+ + SO42- ---> BaSO4
0,03...0,025...---> 0,025
=> nBa2+ dư = 0,005
NH4+ + OH- ---> NH3 + H2O
0,05...0,06...-->...0,05
=> nOH- dư = 0,01
\(\sum m=\)mNa+ + mCl- + mBa2+ dư + mOH- dư
= 0,12.23 + 0,12.35,5 + 0,05.137 + 0,01.17
= 7,875(g)

bảo toàn điện tích ta có: 0,1*2+0,1=x+y =0,3
lại có 30,9= 0,1*137+0,1*39+35,5*x+62*y
giải hệ x,y ta có : x=0,2; y=0,1

+ 1/2 X + NaOH dư:
\(n_{BaCO_3}=\dfrac{9,85}{197}=0,05mol\)
\(Ba^{2+}+HCO_3^-+OH^-\rightarrow BaCO_3\downarrow+H_2O\)
................0,05<-----------------0,05
\(\Rightarrow n_{HCO_3^-}=2.0,05=0,1mol\)
+ 1/2 X + NaHSO4 dư:
\(n_{BaSO_4}=\dfrac{17,475}{233}=0,075mol\)
\(HSO_4^-+HCO_3^-\rightarrow SO_4^{2-}+CO_2\uparrow+H_2O\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
\(Ba^{2+}+HSO_4^-\rightarrow BaSO_4\downarrow+H^+\) (nếu có)
\(\Rightarrow n_{Ba^{2+}}=2.0,075=0,15mol\)
Áp dụng định luật bảo toàn điện tích vào dung dịch X:
\(n_{HCO_3^-}+n_{Cl^-}=2n_{Ba^{2+}}+n_{Na^+}\)
\(\Rightarrow0,1+0,3=2.0,15+n_{Na^+}\Rightarrow n_{Na^+}=0,1mol\)
+ Đun nóng X:
\(2HCO_3^-\rightarrow^{t^0}CO_3^{2-}+CO_2\uparrow+H_2O\)
0,1------------>0,05
\(Ba^{2+}+CO_3^{2-}\rightarrow BaCO_3\downarrow\)
0,05<---0,05------->0,05
\(n_{Ba^{2+}}\text{còn}=0,15-0,05=0,1mol\)
=> Dung dịch X có chứa: 0,1 mol Ba2+; 0,1 Na+; 0,3 mol Cl-
\(\Rightarrow m_{\text{muối}}=137.0,1+23.0,1+35,5.0,3=26,65\left(gam\right)\)
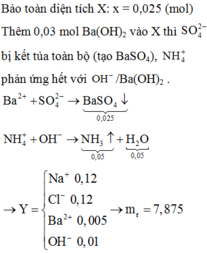
Đáp án C