Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 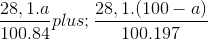 = 0,2
= 0,2
=> a = 29,89.

Gọi số mol của Mg, Al ,Cu có trong hỗn hợp lần lượt là a, b, c (mol) (a,b,c>0)
2Mg + O2 --t*--> 2MgO (1)
...a............................a (mol)
4Al + 3O2 --t*--> 2Al2O3 (2)
...b............................b/2 (mol)
2Cu + O2 --t*--> 2CuO (3)
...c.............................c (mol)
Khi m (g) hỗn hợp 3 kim loại trên tác dụng với HCl dư => Cu không phản ứng với HCl
Mg + 2HCl ---> MgCl2 + H2 (4)
..a...................................a (mol)
2Al + 6HCl ---> 2AlCl3 + 3H2 (5)
..b....................................3b/2 (mol)
Theo đầu ta có 24a + 27b + 64c = m (I)
..........................40a + 51b + 80c = 1,72m (II)
.......................... a + 3b/2 + 0c = 0,952m/22,4 (III)
Vì m(g) là 1 đại lượng chưa biết và cả 3 pt trên đều chứa m ở vế phải nên ta có thể giả sử m=1 (g) (Khi thay
m=1 không ảnh hưởng đến % khối lượng các chất có tronh hỗn hợp)
Khi đó thay m=1 vào (I), (II) (III) ta được:
(I) <=> 24a + 27b + 64c = 1
(II) <=> 40a + 51b + 80c = 1,72
(III) <=> a + 3b/2 +0c=0,0425
Giải hệ phương trình 3 ẩn (cái này nên dùng bằng máy tính là nhanh nhất) trên ta được
a = 0,0125 (mol) => mMg = 0,3g => %Mg=0,3/1.100%=30%
b = 0,02 (mol) => mAl = 0,54g => %Al= 0,54/1.100%=54%
c = 0,0025 (mol) => mCu = 0,16g => %Cu=0,16/1.100%=16%

Mg + HCl - MgCl2 + H2
Al + HCl - AlCl3 + H2
còn Cu đứng sau H nên không phản ứng với HCl.
nCuO = \(\dfrac{16}{80}=0,2\) mol
Pt: 2Cu + O2 --to--> 2CuO
0,2 mol<--------------0,2 mol
.....Mg + 2HCl --> MgCl2 + H2
0,2 mol<-----------0,2 mol
.....2Al + 6HCl --> 2AlCl3 + 3H2
....MgCl2 + 2NaOH --> Mg(OH)2 + 2NaCl
...0,2 mol<---------------0,2 mol
....AlCl3 + 3NaOH --> Al(OH)3 + 3NaCl
....Al(OH)3 + NaOH --> NaAlO2 + 2H2O
..........................................(tan)
...Mg(OH)2 --to--> MgO + H2O
0,2 mol<------------ 0,2 mol
nMgO = \(\dfrac{8}{40}=0,2\) mol
mCu = 0,2 . 64 = 12,8 (g)
mMg = 0,2 . 24 = 4,8 (g)
mAl = mhh - mCu - mMg = 20 - 12,8 - 4,8 = 2,4 (g)
% mCu = \(\dfrac{12,8}{20}.100\%=64\%\)
% mMg = \(\dfrac{4,8}{20}.100\%=24\%\)
% mAl = \(\dfrac{2,4}{20}.100\%=12\%\)

(a) Kim loại là chất khử, ion kim loại có thể là chất khử hoặc chất oxi hóa.
(b) Ăn mòn hoá học không làm phát sinh dòng điện.
(d) Bôi dầu mỡ, sơn, mạ, tráng men lên bề mặt vật dụng bằng kim loại để chống sự ăn mòn kim loại.
Đáp án B

2Al + 2NaOH + 2H2O -> 2NaAlO2 + 3H2
0,2
=> mAl = 27.0,2 = 5,4 (gam) => %mAl = 5,4 %.
Gọi số mol của Fe và Cr trong hỗn hợp là x và y.
Fe + 2HCl -> FeCl2 + H2
x x(mol)
Cr + 2HCl -> CrCl2 + H2
y y
Ta có các phương trình : x + y = = 1,7 (1)
56x + 52y = 94,6 (2).
Giải hệ hai phương trình (1) và (2) ta được x = 1,55 ; y = 0,15.
=> mFe = 56.1,55 = 86,8 gam ; %mFe = 86,8%.
Và mCr = 52.0,15 = 7,8 (gam) ; %mCr = 7,8 %.
Đáp án B
(a) Nguyên tử của hầu hết các nguyên tố kim loại đều có ít electron ở lớp ngoài cùng.
(c) Bôi dầu mỡ, sơn, mạ, tráng men lên bề mặt vật dụng bằng kim loại để chống sự ăn mòn kim loại.
(d) Cho Al tác dụng với dung dịch hỗn hợp gồm HCl và CuSO4, sẽ xảy ra hiện tượng ăn mòn hóa học và ăn mòn điện hóa học.