Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, nCaCO3=10/100=0,1 mol
PTHH: CaCO3+2HCl---> CaCl2+CO2+H2O
Theo pthh ta có: nCaCl2=nCaCO3=0,1 mol
=> mCaCl2=0,1.111=11,1 (g)
b, nCaCO3=5/100=0,05 mol
Theo pthh ta có : nCO2=nCaCO3=0,05 mol
=> VO2(điều kiện phòng)= 0,05.24= 1,2 l
a) Số mol canxi cacbonat tham gia phản ứng
=
= 0,1 mol
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Theo phương trình hóa học, ta có:
=
= 0,1 mol
Khối lượng của canxi clotua tham gia phản ứng:
= 0,1 . (40 + 71) = 11,1 g
b) Số mol canxi cacbonat tham gia phản ứng:
=
= 0,05 mol
Theo phương trình hóa học, ta có:
=
= 0,05 mol
Thể tích khí CO2 ở điều kiện phòng là:
= 24 . 0,05 = 1,2 lít

a, Tìm thể tích khí H2 thu được \(\left(\text{đ}ktc\right)\)
- Phương trình hóa học :
Fe + 2HCl ➝ FeCl2 + H2
- Số mol Fe tham gia phản ứng :
nFe=\(\dfrac{2,8}{56}\)=0,05 mol
=Theo phương trình hóa học :
nH2=nFe=0,05 mol
Thể tích khí H2thu được ở đktc :
VH2= 22,4 . 0,05 = 1,12 lít
b , Khối lượng HCl cần dùng
- Theo phương trình hóa học :
nHCl=2nFe= 2 . 0,05 = 0,10 mol
- Khối lượng HCl cần dùng là :
mHCl=36,5 . 0,10 = 3,65 gam

a) Ta có:
\(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right)\\ n_{Cu}=\dfrac{64}{64}=1\left(mol\right)\\ n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
b) Ta có:
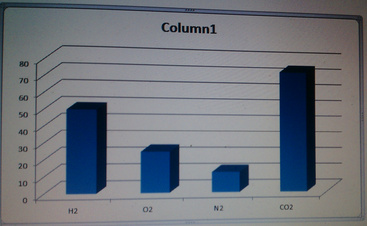
Thể tích của 0,175 mol CO2 (ở đktc):
\(V_{CO_2\left(đktc\right)}=0,175.22,4=3,92\left(l\right)\)
Thể tích của 1,25 mol H2 (ở đktc):
\(V_{H_2\left(đktc\right)}=1,25.22,4=28\left(l\right)\)
Thể tích của 3 mol N2 (ở đktc):
\(V_{N_2\left(đktc\right)}=22,4.3=67,2\left(l\right)\)
c) Ta có: \(n_{CO_2}=\dfrac{0,44}{44}=0,01\left(mol\right)\\ n_{H_2}=\dfrac{0,04}{2}=0,02\left(mol\right)\\ n_{N_2}=\dfrac{0,56}{28}=0,02\left(mol\right)\)
Số mol hỗn hợp: \(n_{hh}=0,01+0,02+0,02=0,05\left(mol\right)\)
Thể tích hỗn hợp (đktc):\(V_{hh}=0,01.22,4+0,02.22,4+0,02.22,4=1,12\left(l\right)\)
a)
nFe = = 0,5 mol
nCu = = 1 mol
nAl = = 0,2 mol
b) Thể tích khí ở đktc:
= 22,4 . 0,175 = 3,92 lít
= 22,4 . 1,25 = 28 lít
= 22,4 . 3 = 67,2 lít
c) Số mol và thể tích của hỗn hợp:
=
= 0,01 mol;
= 22,4 . 0,01 = 0,224 lít
=
= 0,02 mol;
= 22,4 . 0,2 = 0,448 lít;
=
= 0,02 mol;
= 22,4 . 0,02 = 0,448 lít.
Vậy số mol của hỗn hợp là:
nhh = 0,01 + 0,02 + 0,02 = 0,05 mol
Thể tích hỗn hợp là:
Vhh = 0,224 + 0,448 + 0,448 = 1,12 lít
Hoặc Vhh = 0,05 . 22,4 = 1,12 lít

a) PTPU

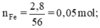
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (l)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)

Phản ứng a, b và d là phần oxi hóa khử.
+ Câu a phản ứng đốt than trong lò tỏa nhiệt tạo ta nhiệt lượng cần thiết.
+ Câu b là phản ứng khử với oxit sắt, sau phản ứng ta thu được kim loại sắt trong công nghiệp luyện kim.
+ Câu c phản ứng nung đá vôi tạo ra vôi sống (CaO) đây là phản ứng phân hủy giúp ta có vôi sống để dùng trong công nghiệp hay xây dựng công trình dân dụng.
+ Câu d là phản ứng hóa hợp, sản phẩm tạo thành là sắt (III) oxit, đây là phản ứng có hại, làm gỉ sắt kim loại, các vật dụng khác.
Những phản ứng oxi hóa – khử là a), b) ,d).
Phản ứng (a) Lợi: sinh ra nhiệt năng để sản xuất phục vụ đời sống. Tác hại: sinh ra khí CO2làm ô nhiễm môi trường.
Phản ứng (b) Lợi: luyện quặng sắt thành gang điều chế sắt. Tác hại: sinh ra khí CO2 làm ô nhiễm môi trường.
Phản ứng (d) Tác hại: Làm sắt bị gỉ, làm hư hại các công trình xây dựng, các dụng cụ và đồ dùng bằng sắt.

2)M khí A= 17*2=34
cong thức tổng quát: HxSy
có:
M của H/ M khí A= % H
<=>H*x/M=5,88%
<=>1*x/34=5,88%
suy ra: x=2
=> y =1
công thức đúng là: H2S
1) Theo như SGK thì có 2,8g Fe, bạn ghi thiếu đề
a) nFe = 2,8 / 56 = 0,05 mol Phương trình hoá học: Fe + 2HCl -----> FeCl2 + H2 0, 05 mol 2.0,05 mol 0,05 mol Theo phương trình trên ta có nFe = nH = 0,05 VH2= 0,05 x 22,4 = 1,12 l. b) nHCl = 2nFe = 2 x 0,05 = 0,1 mol mHCl cần dùng: 0,1 x 36,5 = 3,65 g.

Số mol của H2 là
n=V:22,4=5,6:22,4
=0,25(mol)
Số mol của Zn là
nZn=nH2=0,25(mol)
Khối lượng của Zn là
m=n.M=0,25.65=16,25(g)
Số mol của H2SO4 là
nH2SO4=nH2=0,25(mol)
C)cách1:
Khối lượng của H2SO4 là
m=n.M=0,25.98=24,5(g)
Khối lượng H2 là
m=n.M=0,25.2=0,5(g)
Áp dụng định luật bảo toàn khối lượng ta có:
mZn+mH2SO4=mZnSO4+mH2
->mZnSO4=mH2SO4+mZn-mH2=24,5+16,25-0,5=40,25(g)
Cách2:
Số mol của ZnSO2 là
nZnSO4=nH2=0,25(mol)
Khối lượng của ZnSO4 là
m=n.M=0,25.161=40,25(g)
D) số mol của H2SO4 là
n=m:M=9,8:98=0,1(mol)
So sánh:nZnbđ/pt=0,2/1>
n2SO4bđ/pt=0,1/1
->Zn dư tính theoH2SO4
Số mol của H2 là
nH2=nH2SO4=0,1(mol)
Thể tích của H2 là
V=n.22,4=0,1.22,4=2,24(l)
Ta có : \(n_{H_2}=\frac{V}{22,4}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
\(PTHH:Zn+H_2SO_4_{ }---^{t^o}\rightarrow ZnSO_4+H_2\uparrow\) (1)
Theo PTHH=>1mol Zn tham gia phản ứng tạo ra 1 mol khí H2
Theo bài ra , x mol Zn tham gia phản ứng tạo ra 0,25 mol khí H2
\(\Rightarrow x=0,25\left(mol\right)\)
a) Ta có : \(m_{Zn}=m.M=0,25.65=16,25\left(g\right)\)

Trước tiên ta cần chuyển đổi khối lượng các khí ra số mol phân tử. Số mol của các chất khí:
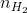 =
=  = 0,5 mol;
= 0,5 mol; 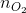 =
= 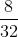 = 0,25 mol
= 0,25 mol
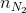 =
= 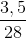 = 0,125 mol;
= 0,125 mol; 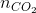 =
= 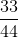 = 0,75 mol.
= 0,75 mol.
Tỉ lệ về số mol các khí cũng là tỉ lệ về thể tích các chất khí ở cùng một điều kiện, ta có sơ đồ biểu diễn:

\(n_{Fe}=\frac{14}{56}=0,25\left(mol\right)\)
\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
(mol)____0,25___0,5____________0,25
\(a.m_{HCl}=0,5.36,5=18,25\left(g\right)\)
\(b.V_{H_2}=22,4.0,25=5,6\left(l\right)\)
\(n_{Fe}=\frac{m_{Fe}}{M_{Fe}}=\frac{14}{56}=0,25\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0,25\) \(0,5\) \(0,25\) \(0,25\) \(\left(mol\right)\)
a) \(m_{HCl}=n_{HCl}.M_{HCl}=0,5.36,5=18,25\left(g\right)\)
b) \(V_{H_2}=n_{H_2}.22,4=0,25.22,4=5,6\left(l\right)\)
Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: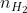 = nFe = 0,05 mol
= nFe = 0,05 mol
Thể tích khí thu được ở đktc là: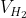 = 22,4 . n = 22,4 . 0,05 = 1,12 lít
= 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g
Bài giải:
Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: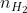 = nFe = 0,05 mol
= nFe = 0,05 mol
Thể tích khí thu được ở đktc là: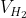 = 22,4 . n = 22,4 . 0,05 = 1,12 lít
= 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g