Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Môi trường axit là môi trường trong đó [H+] > [OH-] hay [H+] > 10-7 M hoặc pH < 7.
- Môi trường trung tính là môi trường trong đó [H+] = [OH-] = 10-7 M hoặc pH = 7.
- Môi trường kiềm là môi trường trong đó [H+] < [OH-] hay [H+] < 10-7 MM hoặc pH > 7.

Theo thuyết A-rê-ni-ut thì:
– Axit là chất khi tan trong nước phân li ra cation H+
Ví dụ: HCl → H+ + Cl–
– Bazơ là chất khi tan trong nước phân li ra anion OH–
Ví dụ : NaOH → Na+ + OH–
– Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Zn(OH)2 ⇔ Zn2+ +20H– ; Zn(OH)2 ⇔ ZnO2-2 + 2H+
2. Những axit mà tan trong nước phân li nhiều nấc ra ion H+ gọi là các axit nhiều nấc.
Ví dụ : H2SO4, H3PO4….
Những bazơ khi tan trong nước phân li nhiều nấc ra ion OH– gọi là các bazơ nhiều nấc. Ví dụ : Mg(OH)2, Ca(OH)2,….
3. Muối là hợp chất, khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit. Ví dụ : Na2CO3 → 2Na+ + CO32-
Muối trung hòa là muối mà anion gốc axit không có khả năng phân li ra ion H+. Muối axit là muối mà anion gốc axit có khá năng phân li ra ion H+.
Sự điện li cùa muối trong nước tạo cation kim loại (hoặc NH4+ , ion phức) và anion gốc axil.

[H+] = 0,01M = 10-2M => pH = 2
[OH-] = 10-14 / 10-2M =10-12
Dung dịch có pH = 2 < 7 => môi trường axit, quỳ tím có màu đỏ.

nNO = \(\dfrac{6,72}{22,4}\) = 0,300 (mol)
nHNO3nHNO3 = 1,00 x 1,5 = 1,5 (mol)
pthh: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
Theo (1) ta tính được nCu = 0,45 mol => mCu = 28,8 gam
nHNO3nHNO3 = 1,2 mol
nCu(NO3)2nCu(NO3)2 = 0,45 mol
mCuO = 30 gam – 28,8 gam = 1,2 gam => nCuO = 0,015 mol
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo (2) ta tính được nHNO3nHNO3 là 0,030 mol, nCu(NO3)2nCu(NO3)2 là 0,015 mol
Phần tram khối lượng CuO: % mCuO = \(\dfrac{1,2}{30}\) . 100% = 4,0 %
Từ (1) và (2) ta tính được số mol HNO3 dư là 0,27 mol.
Nồng độ mol HNO3 sau phản ứng: 0,18 M
Nồng độ mol của Cu(NO3)2: 0,31 M

Phản ứng giữa dung dịch axit và hiđroxit có tính bazơ rất dễ xảy ra vì có sự tạo thành chất điện li rất yếu là H2O Ví dụ: Mg(OH)2 + 2HCl \(\rightarrow\) MgCl2 + 2H2O
Phản ứng giữa muối cacbonat và dung dịch axit dễ xảy ra vì có sự tạo thành chất khí là CO2
Ví dụ: Na2CO3 + 2HCl \(\rightarrow\) 2NaCl + CO2 \(\uparrow\)+ H2O

- Những tính chất khác biệt:
+ Với axit H2SO4 loãng có tính axit, còn H2SO4 đặc mới có tính oxi hoá mạnh, còn axit HNO3dù là axit đặc hay loãng đề có tính oxi hoá mạnh khi tác dụng với các chât có tính khử.
+ H2SO4 loãng không tác dụng được với các kim loại đứng sau hiđro trong dãy hoạt động hoá học như axit HNO3.
Fe +H2SO4 (loãng) → FeSO4 + H2
Cu +H2SO4 (loãng) : không có phản ứng
- Những tính chất chung:
+ Với axit H2SO4 loãng và HNO3 đều có tính axit mạnh
+ Thí dụ:
Đổi màu chất chỉ thị: Quỳ tím chuyển thành màu hồng
Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
2Fe(OH)2 + 3H2SO4 → Fe2(SO4)3+ 6H2O
Fe2O3 + 6HNO3 → 2Fe(HNO3)3+ 3H2O
HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2
+ Với axit H2SO4(đặc) và axit HNO3 đều có tính oxi hoá mạnh
+ Thí dụ:
Tác dụng được với hầu hết các kim loại (kể cả kim loại đứng sau hiđro trong dãy hoạt động hoá học) và đưa kim loại lên số oxi hoá cao nhất.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Cu + 2H2SO4(đặc) → CuSO4 + SO2 + 2H2O
Tác dụng với một số phi kim (đưa phi kim lên số oxi hoá cao nhất)
C + 2H2SO4(đặc) → CO2 + 2SO2 + 2H2O
S+ 2HNO3 → H2SO4 +2NO
Tác dụng với hợp chất( có tính khử)
3FeO +10HNO3 → 3Fe(NO3)3 + NO + 5H2O
2Fe(OH)2 + 4H2SO4(đặc) → Fe2(SO4)3 + SO2 + H2O
Cả hai axit khi làm đặc nguội đều làm Fe và Al bị thụ động hoá (có thể dùng bình làm bằng nhôm và sắt để đựng axit nitric và axit sunfuaric đặc)
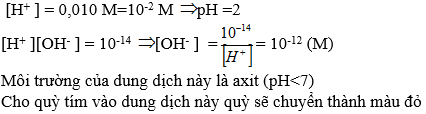



https://cunghocvui.com/bai-viet/bai-2-trang-14-sach-giao-khoa-hoa-11.html
bạn tham khảo link này nhé!