Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a.Cu+2AgNO_3->Cu\left(NO_3\right)_2+2Ag\)
b. m Cu tăng vì sau phản ứng tạo Ag (M = 108), M(Ag) > M(Cu) = 64 nên khối lượng thanh đồng tăng.
\(m_{Cu\left(PƯ\right)}=64x\left(g\right)\\ m_{Ag}=108.2x=216x\left(g\right)\\ c.\Delta m_{rắn}=13,6-6=216x-64x\\ x=0,05mol\\ m_{Cu\left(PƯ\right)}=64x=3,2g\\ d.Cu:dư\\ n_{AgNO_3}=2x=0,1mol\\ m_{AgNO_3}=170\cdot0,1=17g\)

\(a.Zn+CuSO_4->ZnSO_4+Cu\)
b. m Zn giảm vì sau phản ứng tạo Cu (M = 64), M(Cu) < M(Zn) = 65 nên khối lượng lá Zn tăng.
\(m_{Zn\left(Pư\right)}=65x\left(g\right)\\ m_{Cu}=64x\left(g\right)\\c.\Delta m_{rắn}=25-24,96=65x-64x\\ x=0,04mol\\ m_{Zn\left(Pư\right)}=65x=2,6g< 25g\Rightarrow Zn:hết\\d. n_{CuSO_4}=160x=6,4g\)

a) Khi ngâm lá sắt vào dung dịch X thì không thấy khí thoát ra nên Cuo và H2SO4 phản ứng vừa đủ với nhau .
\(CuO+H_{2^{ }_{ }}SO_{4_{ }}\rightarrow CuSO_{4_{ }}+H_2O\left(1\right)\)
Khi dung dịch X không còn màu xanh thì CuSO4 đã phản ứng hết
\(CuSO_4+Fe\rightarrow FeSO_{4_{ }}+Cu\left(2\right)\)
Theo phản ứng (1) và (2)
\(n_{Cuo}=n_{H_2SO_4}=n_{CuSO_4}=n_{Cu}=\frac{2}{64-56}=0,25\left(mol\right)\)
Nồng độ phần trăm của dung dịch H2SO4
\(C\%_{H_2SO_4}=\frac{0,25.98}{122,5}.100\%=20\%\Rightarrow C=20\)
b) Khối lượng của dung dịch sau phản ứng:
\(m_{dd}=m_{CuO}+m_{ddH_2SO_4}-\left(m_{Cu}-m_{Fe}\right)=20+122,5-2=140,5\left(g\right)\)
Theo phản ứng (2) :
\(n_{FeSO_4}=n_{Cu}=0,25\left(mol\right)\Rightarrow m_{FeSO_4}=0,25.152=38\left(g\right)\)
Nồng độ phần trăm của dung dịch sau khi lấy sắt ra là:
\(C\%_{FeSO_4}=\frac{38}{140,5}.100\%=27,05\%\)

PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
Đặt \(n_{Fe\left(phản.ứng\right)}=x\left(mol\right)=n_{Cu\left(tạo.ra\right)}\)
\(\Rightarrow64x-56x=0,8\) \(\Rightarrow x=0,1\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe\left(phản.ứng\right)}=0,1\cdot56=5,6\left(g\right)\\m_{Cu\left(tạo.ra\right)}=0,1\cdot64=6,4\left(g\right)\end{matrix}\right.\)

a/ PTHH: 2Cu + O2 ===> 2CuO
Áp dụng định luật bảo toàn khối lượng
=> mCu + mO2 = mCuO > mCu ( vì mO2 > 0 )
b/ Theo phần a/
mCu + mO2 = mCuO
<=> mO2 = mCuO - mCu = 23,2 - 20 = 3,2 gam
c/ nCuO = 16 / 80 = 0,2 mol
=> nCu = 0,2 mol
=> mCu(pứ) = 0,2 x 64 = 12,8 gam
=> mCu(dư) = 20 - 12,8 = 7,2 gam
=> %mCu(dư) = \(\frac{7,2}{23,2}.100\%=31,03\%\)
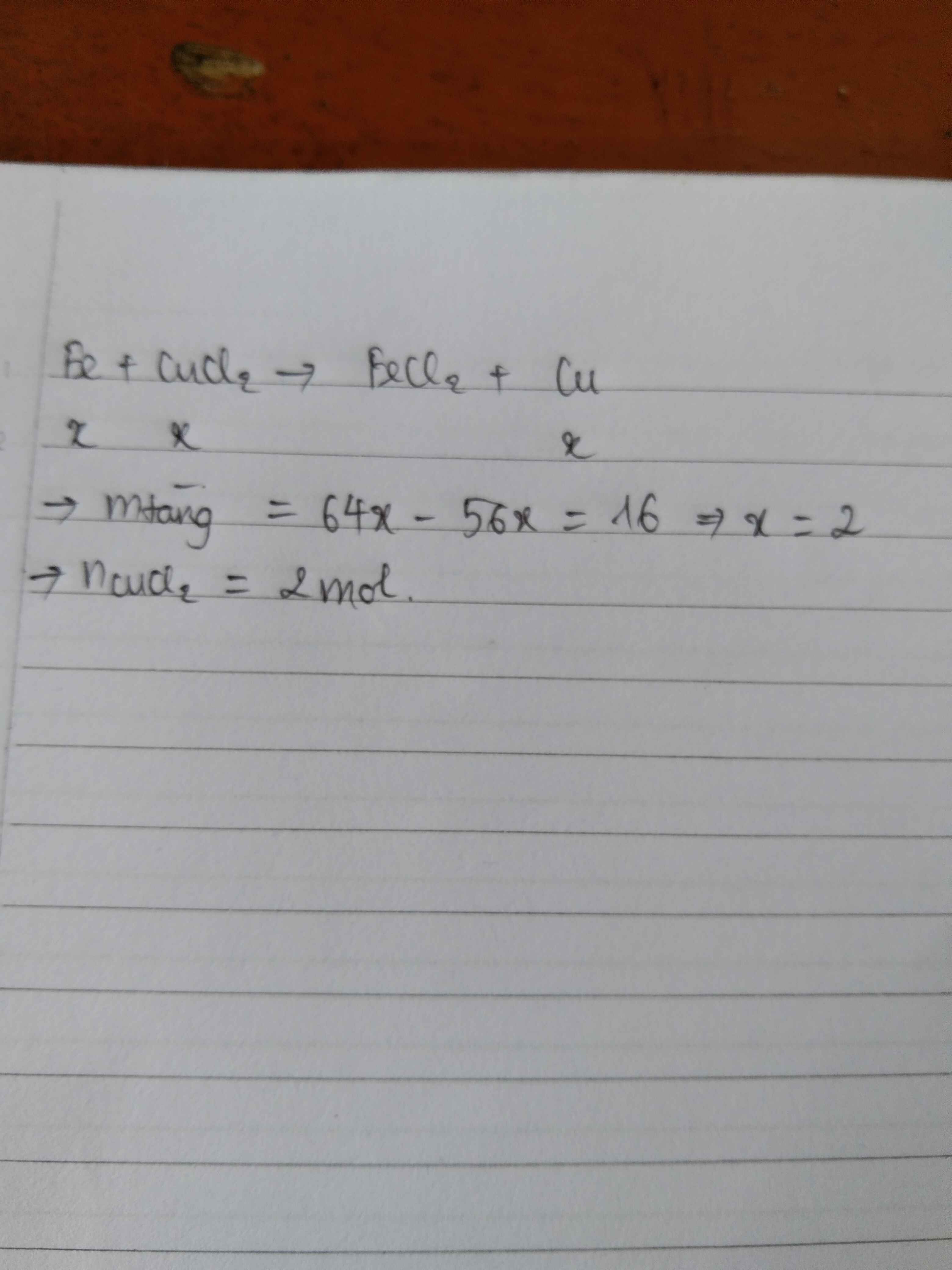
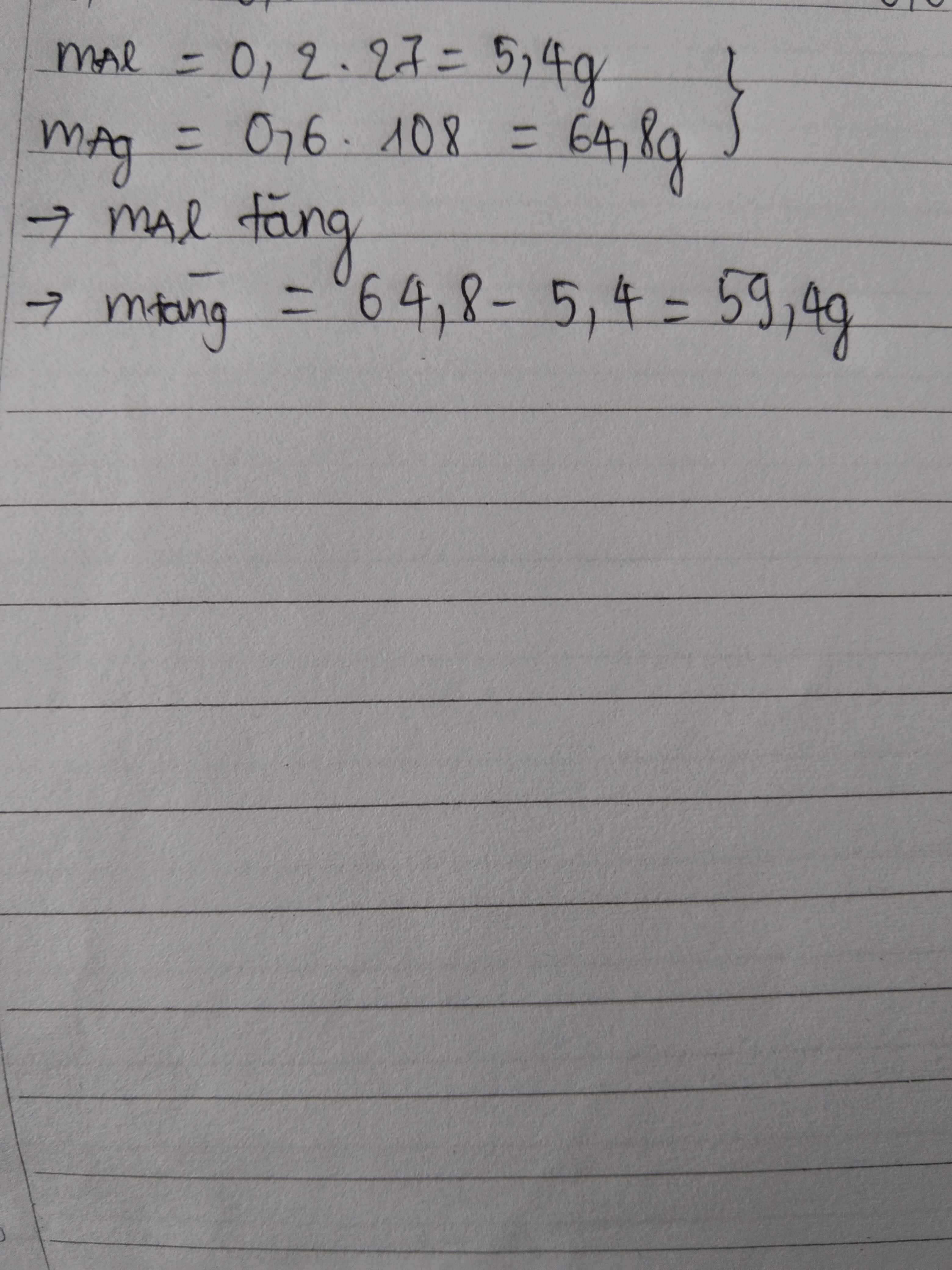
đây là dạng toán tăng giảm khối lượng.
Hơn nữa bạn cũng tự suy luận được là đề thiếu mà, không có lượng chất tham gia và chỉ có khối lượng bạc bám lên thanh đồng sao tính được khối lượng ban đâu của đồng
ha thuyduong