Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Coi như hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 gồm có x mol Fe và y mol O
Ta có 56x+16y= 11,36 (1)
Ta có nNO= 0,06 mol
QT cho e :
Fe → Fe3++ 3e
x 3x mol
QT nhận e :
O+ 2e→ O-2
y 2y mol
N+5+ 3e → NO
0,18←0,06
Theo ĐL BT electron thì : ne cho= ne nhận nên 3x= 2y+ 0,18 (2)
Từ (1) và (2) ta có x= 0,16 và y= 0,15
Bảo toàn nguyên tố Fe có nFe(NO3)3= nFe= x= 0,16 mol→ mFe(NO3)3=38,72 gam
Đáp án D

\(n_{NO}=\dfrac{0,672}{22,4}=0,03mol\)
\(\Rightarrow n_{HNO_3}=4n_{NO}=4\cdot0,03=0,12mol\)
\(\Rightarrow n_{NO_3^-}=0,12mol\)
\(m_{muối}=m_{kl}+62n_{NO_3^-}=5,68+62\cdot0,12=13,12g\)
\(n_{NO}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
Quy đổi hỗn hợp X về Fe (x mol) và O (y mol)
Ta có: mX = mFe + mO → 56x + 16y = 5,68 (1)
Các quá trình trao đổi electron:
\(\overset{0}{Fe}\rightarrow\overset{+3}{Fe}+3e\)
\(\overset{0}{O}+2e\rightarrow\overset{-2}{O}\)
\(\overset{+5}{N}+3e\rightarrow\overset{+2}{N}\)
Áp dụng bảo toàn electron: \(3n_{Fe}=2n_O+3n_{NO}\)
\(\Rightarrow3x=2y+3.0,03\rightarrow3x-2y=0,09\left(2\right)\)
Từ (1) và (2) → x = 0,08; y = 0,075
Bảo toàn nguyên tố Fe:
\(nFe\left(NO_3\right)_3=n_{Fe}=0,08\left(mol\right)\)
→ m muối = 0,08.242 = 19,36 gam

Quy đổi hỗn hợp Fe(a), O(b)
->56a+16b=17.2
mmuối =56a+62(2b+0,1.3)=57.4
->a=0.25,b=0.2
Dễ thấy 2a<2b+0,1.3<3a nên muối chưa Fe 2+ và Fe3+
->HNO3 hết
BT e: 2a+2nCu=2b+0,1.3
->nCu=0,1

Đáp án B
Phương pháp:
Bảo toàn electron
Bảo toàn điện tích
Bảo toàn nguyên tố Fe, O, H
Hướng dẫn giải:
Phần kết tủa có nAgCl= 0,3 => nAg = 0,009
Bảo toàn electron: nFe2+ = nAg + 3nNO = 0,036
nNO = 0,009 => nH+ dư = 4nNO = 0,036
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
=> mX = 56a + 232b + 180c = 7,488 (1 )
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
Vậy Y chứa Fe2+ (0,036), H+ (0,036), Cl- (0,3)
Bảo toàn điện tích => nFe3+ = 0,064
Bảo toàn Fe => a + 3b + c = 0,064 + 0,036 (2)
Bảo toàn H => nH2O = 0,144
Bảo toàn O:
4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nZ + nH2O
=> 4b + 6c + 0,024 . 3 = 0,032 + 0,144 (3)
Giải hệ (1)(2)(3): a = 0,05 b = 0,014 c = 0,008
=> %Fe = 37,4%


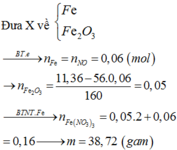

a)
$Fe + 4HNO_3 \to Fe(NO_3)_3 + NO + 2H_2O$
$3Fe_3O_4 + 28HNO_3 \to 9Fe(NO_3)_3 + NO + 14H_2O$
b)
Gọi $n_{Fe} = a(mol) ; n_{Fe_3O_4} = b \Rightarrow 56a + 232b = 9,2(1)$
$n_{NO} = a + \dfrac{1}{3}b = 0,05(2)$
Từ (1)(2) suy ra a = 0,04 ; b = 0,03
$\%m_{Fe} = \dfrac{0,04.56}{9,2}.100\% = 24,35\%$
$\%m_{Fe_3O_4} = 75,65\%$