Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Kết tủa là AgCl
AgNO3 + NaCl → AgCl + NaNO3
=> nNaCl = nAgCl = 17,22/143,5 = 0,12 (mol)
=> %mNaF = ![]() .100 = 41,8%
.100 = 41,8%

Chọn đáp án A
Kết tủa là AgCl.
n A g C l = n N a C l = 0,1.0,1 = 0,01 mol => m = 0,01.143,5 = 1,435 (gam)

Chúc bạn học tốt !!!
\(m_{hh}=74.5a+58.5b=26.6\left(g\right)\left(1\right)\)
\(n_{AgCl}=\dfrac{57.4}{143.5}=0.4\left(mol\right)\)
\(KCl+AgNO_3\rightarrow KNO_3+AgCl\)
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\)
\(n_{AgCl}=a+b=0.4\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=b=0.2\)
\(m_{dd\left(saupư\right)}=26.6+500-57.4=469.2\left(g\right)\)
\(C\%_{KNO_3}=\dfrac{0.2\cdot101}{469.2}\cdot100\%=4.31\%\)
\(C\%_{NaNO_3}=\dfrac{0.2\cdot85}{469.2}\cdot100\%=3.62\%\)

Câu 1:
Gọi số mol NaCl, KCl là a, b (mol)
=> 58,5a + 74,5b = 6,81 (1)
\(n_{AgCl}=\dfrac{14,35}{143,5}=0,1\left(mol\right)\)
Bảo toàn Cl: a + b = 0,1 (2)
(1)(2) => a = 0,04 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}m_{NaCl}=0,04.58,5=2,34\left(g\right)\\m_{KCl}=0,06.74,5=4,47\left(g\right)\end{matrix}\right.\)
Câu 2:
Gọi số mol MgCl2, KCl là a, b (mol)
=> 95a + 74,5b = 3,93 (1)
25ml dd A chứa \(\left\{{}\begin{matrix}MgCl_2:0,05a\left(mol\right)\\KCl:0,05b\left(mol\right)\end{matrix}\right.\)
nAgNO3 = 0,05.0,06 = 0,003 (mol)
=> nAgCl = 0,003 (mol)
Bảo toàn Cl: 0,1a + 0,05b = 0,003 (2)
(1)(2) => a = 0,01 (mol); b = 0,04 (mol)
\(\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,01.95}{3,93}.100\%=24,173\%\\\%m_{KCl}=\dfrac{0,04.74,5}{3,93}.100\%=75,827\%\end{matrix}\right.\)


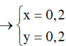
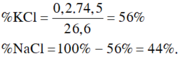
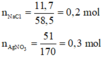

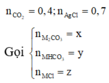

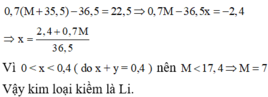
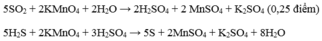

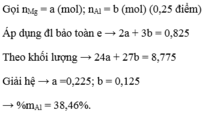
\(AgNO3+NaCl-->NaNO3+AgCl\downarrow\)
\(m_{AgNO3}=\frac{100.17}{100}=17\left(g\right)\)
\(n_{AgNO3}=\frac{17}{170}=0,1\left(mol\right)\)
\(n_{NaCl}=\frac{400.2,94}{100}=11,76\left(g\right)\)
\(n_{NaCl}=\frac{11,76}{58,5}=0,2\left(mol\right)\)
--> NaCl dư
\(n_{AgCl}=n_{AgNO3}=0,1\left(mol\right)\)
\(m_C=m_{AgCl}=0,1.143,5=14,35\left(g\right)\)
dd X gồm NaCl dư và NaNO3
m dd sau pư = mdd AgNO3 + mdd NaCl -m AgCl = 100+400-14,35=485,65(g)
\(n_{NaNO3}=n_{AgNO3}=0,1\left(mol\right)\)
\(m_{NaNO3}=0,1.85=8,5\left(g\right)\)
\(C\%_{NaNO3}=\frac{8,5}{485,65}.100\%=1,75\%\)
\(n_{NaCl}=n_{AgNO3}=0,1\left(Mol\right)\)
\(n_{NaC_{ }l}dư=0,2-0,1=0,1\left(mol\right)\)
\(m_{NaCl}=0,1.58,5=5,85\left(g\right)\)
\(C\%_{NaCl}=\frac{5,85}{485,65}.100\%=1,2\%\)