Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) 2KClO3 -> 2KCl + 3O2
b) MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
b) SGK

a. \(n_{KClO_3}=\dfrac{18.375}{122,5}=0,15\left(mol\right)\)
PTHH : 2KClO3 ----to---> 2KCl + 3O2
0,15 0,225
Phản ứng trên là phản ứng phân hủy . Vì phản ứng phân hủy là một phản ứng hóa học mà trong đó một chất tham gia có thể tạo thành hai hay nhiều chất mới.
b. \(V_{O_2}=0,225.22,4=5,04\left(l\right)\)
c. \(V_{kk}=5,04.5=25,2\left(l\right)\)

a. \(n_{KMnO_4}=\dfrac{118.5}{158}=0,75\left(mol\right)\)
PTHH : 2KMnO4 -----to----> K2MnO4 + MnO2 + O2
0,75 0,375
Phản ứng trên là phản ứng phân hủy . Vì phản ứng phân hủy là một phản ứng hóa học mà trong đó một chất tham gia có thể tạo thành hai hay nhiều chất mới.
b. \(V_{O_2}=0,375.22,4=8,4\left(l\right)\)
c. \(V_{kk}=8,4.5=42\left(l\right)\)
a) 2KMn04 --> K2MnO4 + MnO2 + O2↑
PƯ này thuộc loại PƯ phân hủy
b) Có nKMnO4 = \(\dfrac{118.5}{39+55+16.4}\)=\(\dfrac{3}{4}\)=0,75
=> nO2 = 0,75x \(\dfrac{1}{2}\)=0,375
=> V của O2 là: 0,375 x 22,4=8,4(l)
c) Thể tích của ko khí là: 1/5 x 8,4=1,68(l)

\(n_{KMnO_4}=\dfrac{118,5}{158}=0,75\left(mol\right)\\
pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,75 0,375
=> \(V_{O_2}=0,375.22,4=8,4\left(l\right)\\
V_{kk}=8,4.5=42\left(l\right)\)

Câu 3:
nFe= \(\frac{m_{Fe}}{M_{Fe}}=\frac{5,6}{56}=0,1\left(mol\right)\)
a) PTHH: Fe+ 2HCl -> FeCl2 + H2\(\uparrow\)
Theo PTHH: 1:2:1:1 (mol)
Theo đề bài: 0,1:0,2:0,1:0,1(mol)
b) Theo PTHH và đề bài, ta có:
\(n_{H_2}=n_{Fe}\)= 0,1 (mol)
Thể tích khí sinh ra ở đây là thể tích khí H2
=> Thể tích khí H2 sinh ra (ở đktc):
\(V_{H_2\left(đktc\right)}=n_{H_2}.22,4=0,1.22,4=2,24\left(l\right)\)

Học sinh A, C rap đúng
Học sinh B, D ráp thí nghiệm sai vì ống dẫn khí oxi không đi vào ống nghiêm làm cho khí oxi sẽ mất mát 1 ít.
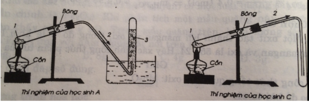
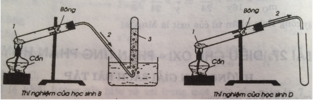

Câu trả lời đúng là C.
PT: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Từ phản ứng này ⇒ có thể điều chế khí H2
Khí H2 nhẹ hơn không khí nên úp ngược ống nghiệm sẽ thu được khí H2

1. Tính khối lượng chất tham gia và sản phẩm
* Các bước giải:
- Đổi số liệu đầu bài. Tính số mol của chất mà đầu bài cho.
- Lập phương trình hoá học.
- Dựa vào số mol chất đã biết để tính số mol chất cần tìm.
2. Tính thể tích khí tham gia và tạo thành
H2+Cl2->2HCl
\(n_{H_2}=67,2:22,4=3\left(mol\right)\)
Ta có: \(n_{H_2}=n_{Cl_2}=3\left(mol\right)\)
\(V_{Cl_2}=3.22,4=67,2l\)
\(n_{HCl}=2n_{Cl_2}=2.3=6\left(mol\right)\)
\(m_{HCl}=6.36,5=219g\)
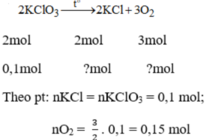
Hình vẽ trên mô tả thí nghiệm điều chế và thu khí H\(_2\).
- CTHH của chất A: HCl ( axit clohidric)
CTHH của chất B: Zn (kẽm)
-PTHH: Zn +2HCl\(\rightarrow\) ZnCl\(_2\) + H\(_2\)\(\uparrow\)
- Người ta thu khí trên bằng phương pháp đẩy nước. Dựa vào tích chất vật lí của H\(_2\) ( nhẹ hơn không khí).
- Tính chất hóa học của khí thu được: Kí hidro có tính khử, ở nhiệt độ thích hợp, hidro ko những kết hợp được với đơn chất oxi, mà nó còn có thể kết hợp với nguyên tố oxi trong một số oxit kim loại. Các phản ứng này đề tỏa ra rất nhiều nhiệt.
Bạn ơi phương pháp đẩy nước phải dựa vào tính chất H2 ít tan trong nước chứ