Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

0,5 tấn = 500kg
\(\rightarrow m_{CaCO_3}=500.\left(100\%-10\%\right)=450kg\)
\(\rightarrow n_{CaCO_3}=\frac{450}{100}=0,45kmol\)
PTHH: \(CaCO_3\rightarrow^{t^o}CaO+CO_2\uparrow\)
Theo phương trình \(n_{CaO}=n_{CaCO_3}=0,45kmol\)
\(\rightarrow m_{CaO}=0,45.56=25,2kg=0,252\) tấn
\(\rightarrow m_{CaO\left(tt\right)}=0,252.85\%=0,2142\) tấn \(=214,2kg\)

\(m_{CaCO_3}=1000\cdot92\%=920\left(g\right)\\ \Rightarrow n_{CaCO_3}=\dfrac{920}{100}=9,2\left(mol\right)\\ PTHH:CaCO_3\rightarrow^{t^0}Cao+CO_2\\ \Rightarrow n_{CaO}=9,2\left(mol\right)\\ \Rightarrow m_{CaO}=9,2\cdot56=515,2\left(g\right)\\ \Rightarrow m_{CaO.thực.tế}=515,2\cdot95\%=489,44\left(g\right)\)

mCaCO3= 80%. m(đá vôi)= 80%. 500=400(g)
-> nCaCO3= mCaCO3/M(CaCO3)=400/100=4(mol)
PTHH: CaCO3 -to-> CaO + CO2
Ta có: nCaO(LT)= nCaCO3= 4(mol)
=> mCaO(LT)=56.4=224(g)
Đặt x là số mol CaCO3 (p.ứ) -> Số mol CaO tạo thành là x (mol) (x>0)
=> Khối lượng rắn tạo thành là:
(400 - 100x) + 56x + 100= 78%. 500
<=>x=2,5(mol)
Vì KL tỉ lệ thuận số mol:
=> H(p.ứ)= (2,5/4).100= 62,5%

CaCO3 -----to---> CaO + CO2
mcaco3 = 100.8,4/56 = 15 tấn
khối lượng đá vôi thực tế cần là:
15:85% :90% = 19,61 tấn

15 tấn = 15 000(kg)
$m_{CaCO_3} = 15000.90\% = 13500(kg)$
$n_{CaCO_3} = \dfrac{13500}{100} = 135(kmol)$
$n_{CaCO_3\ pư} = 135.85\% = 114,75(kmol)$
$CaCO_3 \xrightarrow{t^o} CaO + CO_2$
Theo PTHH : $n_{CaO} = n_{CaCO_3} = 114,75(kmol)$
$m_{CaO} = 114,75.56 = 6426(kg)$
Giải đáp thắc mắc :
100 là phân tử khối của $CaCO_3$
56 là phân tử khối của $CaO$
Cách làm như ảnh trên là áp số tỉ lệ về khối lượng theo PTHH

Tham khảo
mCaCO3= 80%. m(đá vôi)= 80%. 500=400(g)
-> nCaCO3= mCaCO3/M(CaCO3)=400/100=4(mol)
PTHH: CaCO3 -to-> CaO + CO2
Ta có: nCaO(LT)= nCaCO3= 4(mol)
=> mCaO(LT)=56.4=224(g)
Đặt x là số mol CaCO3 (p.ứ) -> Số mol CaO tạo thành là x (mol) (x>0)
=> Khối lượng rắn tạo thành là:
(400 - 100x) + 56x + 100= 78%. 500
<=>x=2,5(mol)
Vì KL tỉ lệ thuận số mol:
=> H(p.ứ)= (2,5/4).100= 62,5%

1tấn đá vôi mà chứa 90% CaCO3 tuc la chua 900kg caco3
nCaCO3=9mol
CaCO3=>CaO+CO2
9mol-------> 9mol->9mol
=> mCaO=9.56=504kg
=> m vôi sống thu được 504:100.95=478,8kg
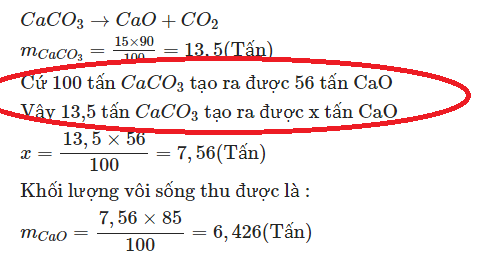
\(m_{CaCO_3}=50\cdot80\%=40\left(tấn\right)=40000\left(kg\right)\)
\(n_{CaCO_3}=\dfrac{40000}{100}=400\left(kmol\right)\)
\(n_{CaCO_3\left(pư\right)}=400\cdot80\%=320\left(kmol\right)\)
\(CaCO_3\underrightarrow{^{t^0}}CaO+CO_2\)
\(320..........320\)
\(m_{CaO}=320\cdot56=17920\left(kg\right)=17.92\left(tấn\right)\)
50 tấn = 50 000 kg
m CaCO3 = 50 000.80% = 40 000(kg)
n CaCO3 pư = 40 000.80%/100 = 320(kmol)
$CaCO_3 \xrightarrow{t^o} CaO + CO_2$
n CaO = n CaCO3 pư = 320(kmol)
m CaO = 320.56 = 17920(kg) = 17,92(tấn)
Đáp án D