Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Trong T có KNO3
KN O 3 → t 0 KN O 2 + 0,5 O 2
Nếu trong T không có KOH, vậy khối lượng chất rắn thu được sau khi nhiệt phân T là khối lượng của KNO2.
mKNO2 = 0,5. 85 = 42,5 > 41,05
=> T gồm KOH dư và KNO2
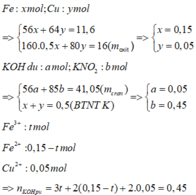


Đáp án B
Giả sử KOH không dư ⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí! ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
-> nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%

Giả sử KOH không dư
⇒ nKNO2 = nKOH = 0,5 mol
⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí!. ⇒ KOH dư.
Đặt nKNO3 = x; nKOH dư = y.
Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư
⇒ 85x + 56y = 41,05
⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
● Đặt nFe = a; nCu = b
⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol.
Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol.
Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng:
mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
► nNO3–/X < 3nFe + 2nCu
⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%
Đáp án B

Đáp án D
Vì dung dịch C đã mất màu hoàn toàn nên cả Ag+ và Cu2+ đều phản ứng hết.
Mà B không tan trong HCl nên B chỉ chứa Ag và Cu. Do đó cả Al và Fe đều phản ứng hết.
Suy ra cho X vào A thì cả 4 chất đều phản ứng vừa đủ.
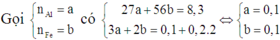
Vì dung dịch E đã nhạt màu nên Ag+ đã phản ứng hết và Cu2+ đã phản ứng một phần.
Do đó D chứa Ag và Cu.
Dung dịch E chứa Al3+, Fe2+ và Cu2+ dư. Khi đó E chứa Fe(OH)2 và Cu(OH)2
Suy ra F chứa Fe2O3 và CuO

Đáp án A
Trong các sản phẩm khử có H2 nên NO3- hết
Sau khi tác dụng với NaOH thì dung dịch thu được chỉ gồm NaCl là KCl
→ nHCl = nNaCl + nKCl = nNaOH + nKNO3 = 0,9mol
Bảo toàn H có nHCl = 2nH2 + 4nNH4 + 2nH2O
→ nH2O = 0,4 mol
BTKL : mA + mHCl + mKNO3 = mmuối + mH2O + mC
→ mA = 20,6 gam
Đặt a, b,c, d lần lượt là số mol của Mg, MgCO3, Fe, Fe(NO3)2
Có mA = 24a + 84b + 56c + 180d =20,6
nO = 3b+ 6d = 20,6. %O : 16 = 0,48
mmuối = 24(a+b) + 56(c + d ) + 0,07.39 + 0,01.18 + 0,09.35,5 = 45,74
moxit = 40 (a +b ) + 160 (c + d ) . ½ = 17,6
Giải hệ được a =0,26; b = 0,1; c= 0,01; d=0,03
→ %Fe = 2,7 %

Đáp án D
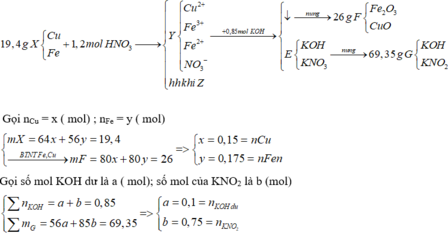
BTNT N => nN(trong Z) = nHNO3 – nNO3- = 1,2 – 0,75 = 0,45 (mol)
Ta thấy 3nFe + 2nCu = 0,875 > nNO3- = 0,75 => sản phẩm trong Y có cả Fe2+, Fe3+. HNO3 đã phản ứng hết
ne(nhường) = 3nFe3+ + 2nFe2+ + 2nCu2+ = nKOH pư = b = 0,75 (mol)
=> trung bình mỗi N+5 đã nhận 0,74/0,45 = 5/3 (electron)
=> NO2 : z ( mol) và NO: t (mol)
=> z + t = 0,45
=> Vhh Z = 0,45.22,4 = 10,08 (lít) gần nhất với 11,02 lít

Đáp án B
2Cu(NO3)2 → t o 2CuO + 4NO2 + O2
Do chất rắn thu được + HNO3 giải phóng khí NO => Cu dư => O2 sinh ra do phản ứng nhiệt phân phản ứng hết với Cu
=> mrắn giảm = mNO2 bay lên= 9,2 (g) => nNO2 =0,2 (mol)
BTNT N => nCu(NO3)2 = ½ nNO2 = 0,1 (mol)
=> % mCu = 31,6 – 0,1.188 = 12,8 (g)
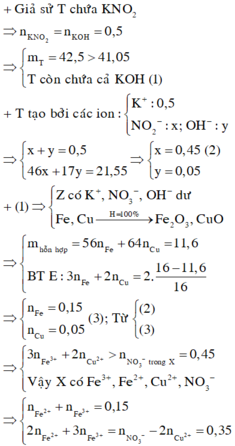
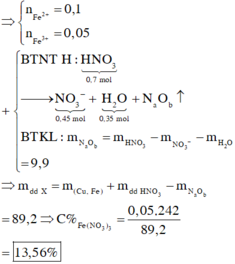

Đáp án B