Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

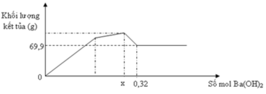
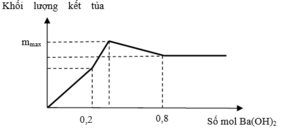
Tại n Ba ( OH ) 2 = 0 , 32 mol thì lượng kết tủa ổn định sau khi đã giảm
→ lúc này OH hòa tan hết Al(OH)3
Lượng kết tủa chỉ có BaSO4: 0,3 mol
Ta có: 4OH−+Al3+→AlO2−+2H2O
→ n Al 3 + = 0 , 16 mol
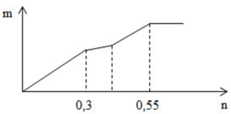
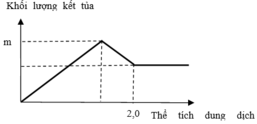
Tại vị trí gấp khúc đầu tiên: đồ thì tăng chậm hơn giai đoạn đầu
→ chứng tỏ lúc này có sự hòa tan Al(OH)3 nhưng lượng kết tủa tăng vì đang tạo thêm BaSO4
Giai đoạn đầu tăng đều vì có sự tăng đồng thời Al(OH)3 và BaSO4
Đến n Ba ( OH ) 2 = x thì lượng BaSO4 tối đa và chỉ còn sự tan Al(OH)3dẫn đến đồ thị đi xuống
→ x = n BaSO 4 = 0 , 3 mol
Đáp án C

Chọn đáp án C.
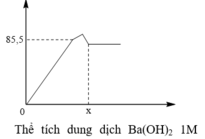
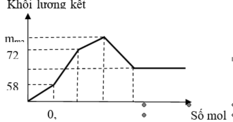
Khi mkết tủa = 85,5 gam, Al2(SO4)3 vừa phản ứng hết, K2SO4 bắt đầu phản ứng.
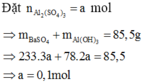
· Khi V dd Ba ( OH ) 2 = x ml, kết tủa Al(OH)3 tan hết, chỉ còn kết tủa BaSO4.
![]()

Đáp án C
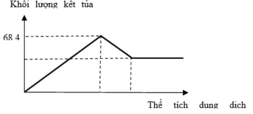
+ Tại n = 0,55 mol: BaSO4 đạt cực đại
nBa2+ = nSO42- => 0,55 = 3a + b
+ Tại n = 0,3 mol: Al(OH)3 bắt đầu bị hòa tan khiến cho lượng kết tủa tăng chậm lại
nOH- = 3nAl3+ => 2.0,3 = 3.2a => a = 0,1
=> b = 0,25
=> a : b = 2 : 5

Giải thích:
Giải thích các quá trình biến thiên trong đồ thị:
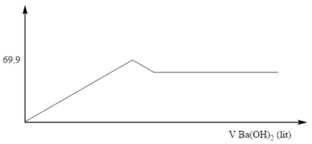
Đoạn 1: Đi lên, do sự hình thành BaSO4 và Al(OH)3
Đoạn 2: Đi xuống, do sự hòa tan kết tủa Al(OH)3
Đoạn 3: Đi ngang, do BaSO4 không tan
Từ đồ thị ta có: mBaSO4 = 69,9 gam => nBaSO4 = 0,3 (mol) => nAl2(SO4)3 = 0,1 (mol) => nAl3+ = 0,2 (mol)
Theo công thức, xuất hiện kết tủa Al(OH)3 sau đó kết tủa tan: nOH- = 4nAl3+ - n↓
=> 0, 8 V = 4. 0,2 -0
=> V = 1 (lít) => gần nhất với Đáp án A là 1,1 lít
Đáp án A






Đáp án C
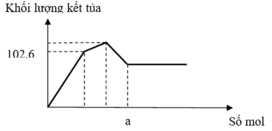
Định hướng tư duy giải
Giai đoạn 1: Tạo đến 102,6 gam kết tủa
là Ba(OH)2 chơi với (x mol) Al2(SO4)3